
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$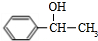 +NaCl
+NaCl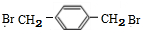 (填结构简式).
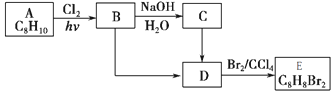
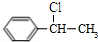
(填结构简式). 分析 A分子式为C8H10,为一取代芳香烃,不饱和度为$\frac{2×8+2-10}{2}$=4,则A为苯的同系物,A在光照条件下得到B,B中含有一个甲基,而D能与溴发生加成反应生成E,则D分子中含有1个C=C双键,可知A为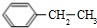 ,B为
,B为 ,B水解生成C为
,B水解生成C为 ,D为
,D为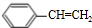 ,E为
,E为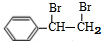 ,以此来解答.
,以此来解答.
解答 解:(1)A为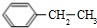 ,名称为乙苯,故答案为:乙苯;
,名称为乙苯,故答案为:乙苯;
(2)由B生成C的化学方程式为 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl,
+NaCl,
故答案为: +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl;
+NaCl;
(3) 在NaOH的醇溶液、加热条件下发生消去反应生成
在NaOH的醇溶液、加热条件下发生消去反应生成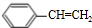 ,由C生成D为醇的消去反应,反应条件为浓硫酸、加热,
,由C生成D为醇的消去反应,反应条件为浓硫酸、加热,
故答案为:NaOH的醇溶液、加热;浓硫酸、加热;
(4)由A生成B为光照下的取代反应、由D生成E为碳碳双键发生的加成反应,
故答案为:取代反应;加成反应;
(5)E为 ,在E的同分异构体中,苯环上一硝化的产物只有一种,若有2个侧链,为-CH2Br,处于对位位置,不可能有3个取代基,若为4个取代基,为2个-Br、2个-CH3,有如下位置关系:4个取代基相邻时,2个Br原子位于2个甲基之间,或者2个甲基位于2个Br原子之间,当两两相邻时,2个Br原子相邻、另外2个甲基相邻,或者是甲基与Br原子相邻且Br原子与另外的甲基处于间位,当3个取代基相邻时,甲基位于2个Br原子中间且2个甲基处于对位位置,或溴原子处于2个甲基之间且2个Br原子处于对位位置,故符合条件的同分异构体有7种,其中只有两种氢原子而且H原子数之比为1:1的物质结构简式是
,在E的同分异构体中,苯环上一硝化的产物只有一种,若有2个侧链,为-CH2Br,处于对位位置,不可能有3个取代基,若为4个取代基,为2个-Br、2个-CH3,有如下位置关系:4个取代基相邻时,2个Br原子位于2个甲基之间,或者2个甲基位于2个Br原子之间,当两两相邻时,2个Br原子相邻、另外2个甲基相邻,或者是甲基与Br原子相邻且Br原子与另外的甲基处于间位,当3个取代基相邻时,甲基位于2个Br原子中间且2个甲基处于对位位置,或溴原子处于2个甲基之间且2个Br原子处于对位位置,故符合条件的同分异构体有7种,其中只有两种氢原子而且H原子数之比为1:1的物质结构简式是 ,
,
故答案为:7; .
.
点评 本题考查有机物的推断及合成,为高频考点,把握有机物的结构、官能团变化、碳链变化为解答的关键,侧重分析与推断能力的考查,注意(5)为解答的难点,题目难度不大.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关物质的分类正确的是
①同素异形体:红磷、P4
②混合物:石英、水玻璃、淀粉、水银、王水、漂白粉
③化合物:HCl、MgCl2、HD
④酸性氧化物:CO2、SO2、Mn2O7
⑤盐:醋酸钠、氯化铵、纯碱、硫氢化钾
⑥弱电解质:CH3COOH、H2O、NH3、BaSO4、HF
⑦高分子化合物:糖类、蛋白质、酚醛树脂
⑧同分异构体:二乙酸乙二酯、乙二酸二乙酯
A.①③⑦B.①④⑤C.②⑥⑧D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 纤维素、甘油分别在浓硫酸存在时与浓硝酸的反应属于同一类型的反应 | |
| D. | 乙醇、乙酸和苯酚的分子中均含有官能团-OH,所以均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com