
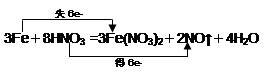 (2分)
(2分) 


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
 2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法正确的是( )| A.KClO3在反应中得到电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被还原 | D.1 mol KClO3参加反应有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要 成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③均是氧化还原反应 |
| B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2 |
| C.反应②中氧化剂与还原剂的物质的量之比为6∶1 |
| D.反应③中0.1mol还原剂共失去电子数为1.2×1022 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2发生还原反应 |
| B.氧化剂与还原剂的物质的量之比为1︰2 |
| C.若反应中生成3molH2O,则转移电子2mol |
| D.理论上利用该反应可以将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com