
【题目】下列不能说明X的电负性比Y大的是 ( )
A. 与氢化合时X单质比Y单质容易
B. X的最高价氧化物对应水化物的酸性比Y的强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X的单质可以把Y从其氢化物中置换出来
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】积极保护生态环境可实现人与自然的和谐共处.
①下列做法会加剧温室效应的是(填字母).
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是(填字母).
a.使用可降解塑料 b.露天焚烧废弃塑料 c.直接填埋废弃塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹.“禁止燃放烟花爆竹”的标识是(填字母).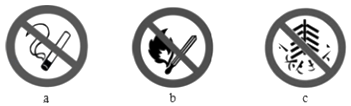
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)是制造草酸、乙醛、醋酸等有机化合物的基本原料。
(1)某小组同学以电石(主要成分为CaC2,含少量CaS及Ca3P2等杂质)为原料,利用下图所示实验装置(夹持装置略去,下同)制备C2H2。

①仪器a的名称为__________________________。
②CaC2的电子式为________________________________。
③装置B中的NaClO溶液能将H2S、PH3氧化为硫酸、磷酸,本身被还原为NaCl。其中PH3被氧化的离子方程式为________________________________。
(2)该小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸能将乙炔气体氧化为草酸(H2C2O4),实验装置如下图所示。

①装置E的作用是_________________________________________。
②装置D中生成H2C2O4的化学方程式为_________________________________。
③装置D中锥形瓶内的液体经过___________(填操作名称)、洗涤、干燥等步骤得到H2C2O4·2H2O晶体。
(3)该小组同学测定了晶体中H2C2O4·2H2O的质量分数,实验步骤如下:
i.准确称取mg晶体,加入适量的蒸馏水溶解,再加入少量稀硫酸;
ii.将i所得溶液用c mol/LKMnO4标准溶液进行滴定,滴定时KMnO4被还原为Mn2+,滴定至终点时消耗标准溶液VmL。
①滴定过程中发现褪色速率先慢后明显加快,除反应放热外,还可能的原因是____________。
②晶体中H2C2O4·2H2O的质量分数为_________(用含m、c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: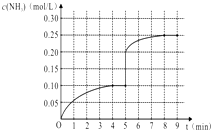
(1)该反应的化学平衡常数表达式为;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .
(3)该反应达到平衡状态的标志是(填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( ) 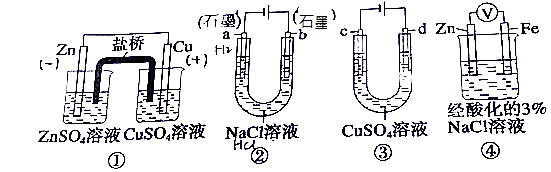
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com