
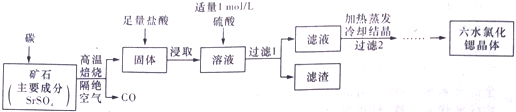
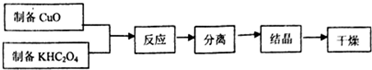
���� SrSO4��̼�����������±�������CO�����壬������������Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�Ȼ��������������ᱵ���������˳�ȥ����Һ�к�SrCl2�ȣ��������Ũ������ȴ�ᾧ��ϴ�ӡ�����õ�SrCl2•6H2O��
��1��SrSO4��̼�����������±��գ�C����������Ӧ����CO����SԪ���ڻ�ԭ�����л��ϼ�Ϊx�����ݵ���ת���غ㣬��6mol����6-x��=16mol�����x=-2���ʻ�ԭ����ΪCrS��
��2������2����еIJ���ϴȥ���ŵ����ʲ����
��3�����������ȥBa2+���ӣ���Ba2+Ũ�ȼ����ᱵ�ܶȻ�������Һ��SO42-��Ũ�ȣ��ٸ���SrSO4���ܶȻ�������Һ��Sr2+�����Ũ�ȣ�
��4����Ag+ ��ȫ��AgSCN��ɫ��������ʽ�������ٵμ�KSCN��Һ�����������ӷ�Ӧ����Һ�ʺ�ɫ��
�ڸ������ĵ�NH4SCN��Һ������ʣ��Ag+ �����ʵ��������������������ӷ�Ӧ����Ag+ �����ʵ������ɵ����������ʵ��������������غ����SrCl2•6H2O���������������㺬����
��� �⣺SrSO4��̼�����������±�������CO�����壬������������Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�Ȼ��������������ᱵ���������˳�ȥ����Һ�к�SrCl2�ȣ��������Ũ������ȴ�ᾧ��ϴ�ӡ�����õ�SrCl2•6H2O��
��1��SrSO4��̼�����������±��գ�C����������Ӧ����CO����SԪ���ڻ�ԭ�����л��ϼ�Ϊx�����ݵ���ת���غ㣬��6mol����6-x��=16mol�����x=-2���ʻ�ԭ����ΪCrS����Ӧ����ʽΪ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
�ʴ�Ϊ��SrSO4+4C$\frac{\underline{\;����\;}}{\;}$SrS+4CO����
��2������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��T���SrCl2•6H2O��
�ʴ�Ϊ��ϴ�ӡ����
��3���������ȡ�����Һ�к�������Ba2+���ʣ����������Ŀ���dz�ȥ��Һ��Ba2+���ʣ�
������Ba2+Ũ��Ϊ1��10-5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10-10������c��SO42-��=$\frac{1.1��1{0}^{-10}}{1��1{0}^{-5}}$mol/L=1.1��10-5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10-7������c��Sr2+��=$\frac{3.3��1{0}^{-7}}{1.1��1{0}^{-5}}$mol/L=0.03mol/L��
�ʴ�Ϊ����ȥ��Һ��Ba2+���ʣ�0.03��
��4����Ag+ ��ȫ��AgSCN��ɫ��������ʽ�������ٵμ�KSCN��Һ���ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
�ʴ�Ϊ����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
��n��NH4SCN��=0.2000mol/L��0.02L=4.0��10-3mol��Ag+��AgSCN��ɫ��������ʽ������������Һ��ʣ���Ag+�����ʵ���Ϊ��n��Ag+��=4.0��10-3mol������Cl-��Ӧ��Ag+�����ʵ���Ϊ��n��Ag+��=1.100��10-2 mol-4.0��10-3mol=7.0��10-3mol��
1.000g��Ʒ��SrCl2•6H2O�����ʵ���Ϊ��n��SrCl2•6H2O��=$\frac{1}{2}$��n��Ag+��=3.5��10-3mol��
1.000g��Ʒ��SrCl2•6H2O������Ϊ��m��SrCl2•6H2O��=3.5��10-3mol��267 g/mol=0.9345g��
���Բ�Ʒ����Ϊ��$\frac{0.9435g}{1g}$��100%=93.45%��
�ʴ�Ϊ��93.45%��
���� ���⿼���Ʊ�ʵ�鷽������ƣ��漰������ԭ��Ӧ�����ʵķ����ᴿ�����Լ��ķ������ۡ��ܶȻ��йؼ��㡢���ʺ����ⶨ���ζ�ԭ��Ӧ�õȣ��ۺ��Խ�ǿ����������ƴ������Ŀ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʽ�ζ��� | B�� | ��ƿ | C�� | ��ʽ�ζ��� | D�� | ���Ͼ�����ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
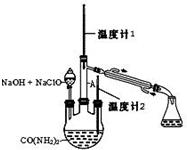 ˮ���� ��N2H4•H2O�� ��������ԭ���Ϳ����������۵�Ϊ-40�棬�е� 118.5�棬������ʵ����������װ����ȡˮ���£�N2H4•H2O���漰���з�Ӧ��
ˮ���� ��N2H4•H2O�� ��������ԭ���Ϳ����������۵�Ϊ-40�棬�е� 118.5�棬������ʵ����������װ����ȡˮ���£�N2H4•H2O���漰���з�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
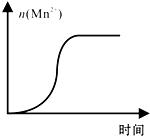 KMnO4������Һ����ᣨH2C2O4����Һ��Ӧʱ����Һ��ɫ������ȥ��ij̽��С���òⶨ�˷�Ӧ��Һ��ɫ��ʧ����ʱ��ķ������о���������Է�Ӧ���ʵ�Ӱ�죮��ʵ����������������
KMnO4������Һ����ᣨH2C2O4����Һ��Ӧʱ����Һ��ɫ������ȥ��ij̽��С���òⶨ�˷�Ӧ��Һ��ɫ��ʧ����ʱ��ķ������о���������Է�Ӧ���ʵ�Ӱ�죮��ʵ����������������| KMnO4������ҺŨ�ȣ�mol•L-1�� | ��Һ��ɫ����ʱ�䣨min�� | ||
| ��һ�� | �ڶ��� | ������ | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4������Һ | H2C2O4��Һ | ||
| Ũ��/mol•L-1 | �����mL�� | Ũ��/mol•L-1 | �����mL�� |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
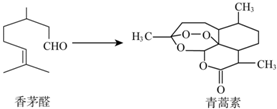 �й���ѧ����������Ϊ���������Ϳ�ű��-�����أ����2015��ŵ�������������ؿ�����éȩΪԭ����ȡ������˵��������ǣ�������
�й���ѧ����������Ϊ���������Ϳ�ű��-�����أ����2015��ŵ�������������ؿ�����éȩΪԭ����ȡ������˵��������ǣ�������| A�� | ��éȩ��ʹBr2��CCl4��Һ��ɫ | B�� | �����ط���ʽΪC15H22O5 | ||
| C�� | �����غ��к�H2O2��ͬ�Ĺ����� | D�� | �������������������ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ԫ��ȫ�����Ǹ���Ԫ�� | |
| B�� | �����ڹ���32��Ԫ�� | |
| C�� | Ԫ�����ڱ����߸����д����߸����ڣ�18�����д���18���� | |
| D�� | ����Ԫ��ԭ�ӵ��������������ڸ�Ԫ�������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com