
设NA为阿佛加德罗常数的值,下列说法不正确的是( )
|
| A. | 常温常压下,1mol氦气含有的原子数为NA |
|
| B. | 常温常压下,8g甲烷中含有的电子数为5NA |
|
| C. | 46gNO2和N2O4混合气体中含有的原子数为3NA |
|
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A、稀有气体是单原子分子;
B、质量换算物质的量,结合甲烷是10电子微粒计算判断;
C、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
D、四氯化碳标准状况不是气体.
解答:
解:A、常温常压下,稀有气体是单原子分子,1mol氦气含有的原子数为NA,故A正确;
B、8g甲烷物质的量=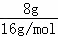 =0.5mol,分子中含有的电子数为5NA,故B正确;
=0.5mol,分子中含有的电子数为5NA,故B正确;
C、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数=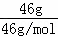 ×3×NA=3NA,故C正确;
×3×NA=3NA,故C正确;
D、四氯化碳标准状况不是气体,11.2L四氯化碳物质的量不是0.5mol,故D错误;
故选D.
点评:
本题考查了阿伏伽德罗常的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的体积应用,注意稀有气体是单原子分子,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验中,所选装置不合理的是()
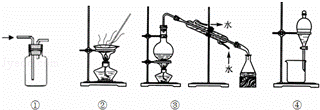
A. 用排空气法收集NH3,选① B. 从食盐水中获得食盐,选②
C. 用自来水制取蒸馏水,选③ D. 用CC14提取碘水中的碘,选④
查看答案和解析>>
科目:高中化学 来源: 题型:
认真观察下列装置,回答下列问题:
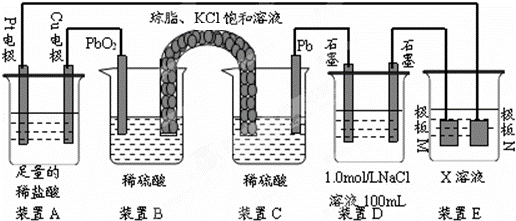
(1)装置B中PbO2上发生的电极反应方程式为 .
(2)装置A中总反应的离子方程式为 .
(3)若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为Ag.若装置E的目的是验证金属的电化学防腐,则极板N的材料为 .
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下).
查看答案和解析>>
科目:高中化学 来源: 题型:
在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是()
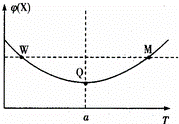
A. 升高温度,平衡常数增大
B. W点Y的正反应速率等于M点Y的正反应速率
C. Q点时,Y的转化率最大
D. 平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于非氧化还原反应的是( )
|
| A. | C+O2 |
|
| B. | CaCO3+2HCl=CaCl2+CO2↑+H2O |
|
| C. | 2Na2O2+2H2O=4NaOH+O2↑ |
|
| D. | Zn+H2SO4=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取时,要收集干燥纯净的氯气,应使氯气依次通过( )
|
| A. | 水、浓H2SO4 | B. | 饱和Na2CO3溶液、浓H2SO4 |
|
| C. | 饱和NaCl溶液、浓H2SO4 | D. | 饱和NaHCO3溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
|
| A. | 甲的分子数比乙的分子数多 |
|
| B. | 甲的物质的量比乙的物质的量少 |
|
| C. | 甲的摩尔体积比乙的摩尔体积小 |
|
| D. | 甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是( )
|
| A. | 1:1:2 | B. | 2:1:3 | C. | 6:3:2 | D. | 3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com