
| A. | N2→NH3 | B. | MgCl2→MgSO4 | C. | Cu→CuO | D. | FeO→Fe |
分析 化学反应中需要加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.N元素化合价由0价变为-3价,N2作氧化剂,需要还原剂才能实现,如氢气等,故A错误;
B.该反应中所有元素化合价不变,不需要发生氧化还原反应即可实现,故B错误;
C.该反应中Cu元素化合价由0价变为+2价,Cu作还原剂,需要氧化剂才能实现,如氧气等,故C正确;
D.Fe元素化合价由+2价变为0价,FeO作氧化剂,需要还原剂才能实现,如氢气、C等,故D错误;
故选C.
点评 本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化与氧化剂、还原剂关系即可解答,熟悉常见元素化合价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含溶质98 g | |
| B. | 从10 mL该溶液中取出5 mL后,剩余溶液的浓度不变 | |
| C. | 将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) | |
| B. | 达到化学平衡时,4υ正(O2)=5υ逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | B. | c(K+)+c(S2-)=0.3mol/L | ||
| C. | c(K+)=2[c(S2-)+c(HS-)+c(H2S)] | D. | c(OH-)=c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中 | |
| B. | 用量筒量取浓硫酸时,俯视刻度线 | |
| C. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 | |
| D. | 定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
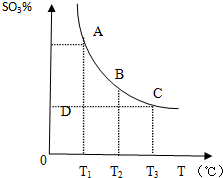 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com