
分析 根据n=$\frac{N}{{N}_{A}}$计算氢氧根离子物质的量,根据m=nM计算其质量,电子物质的量为氢氧根离子的10倍,根据n=$\frac{m}{M}$计算氨气的物质的量.
解答 解:3.01×1023个OH-的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,质量为0.5mol×17g/mol=8.5g,含有电子的物质的量为0.5mol×10=5mol,与OH-质量相同的NH3的物质的量为$\frac{8.5g}{17g/mol}$=0.5mol,
故答案为:0.5;8.5;5;0.5.
点评 本题考查物质的量有关计算,熟练掌握以物质的量为中心的计算公式,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
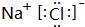 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
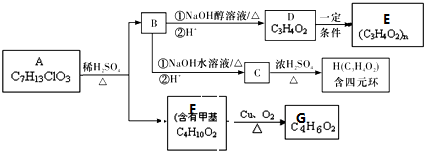
 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
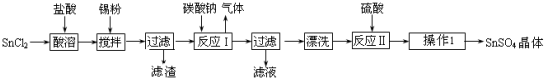
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com