
分析 该反应为可逆反应,处于化学平衡状态时,向其中加入37Cl2,反应过程中分子中化学键断裂,生成原子,原子之间重新组合形成新的化学键,生成新的物质.所以平衡时PCl5、PCl3、Cl2三种物质中都存在37Cl原子,据此分析.
解答 解:反应PCl5(g)?PCl3(g)+Cl2(g)处于化学平衡状态时,PCl3(g)中没有37Cl,向其中加入37Cl2后,可逆反应逆向移动,最后达到新的平衡,反应过程中分子中化学键断裂,生成原子,原子之间重新组合形成新的化学键,生成新的物质.所以新的平衡时PCl5、PCl3、Cl2三种物质中都存在37Cl原子,在建立平衡以后,PCl3(g)中所含37Cl的质量分数比原平衡状态时会增加,
故答案为:增加;向其中加入37Cl2后,可逆反应逆向移动,最后达到新的平衡,反应过程中分子中化学键断裂,生成原子,原子之间重新组合形成新的化学键,生成新的物质.所以新的平衡时PCl5、PCl3、Cl2三种物质中都存在37Cl原子,在建立平衡以后,PCl3(g)中所含37Cl的质量分数比原平衡状态时会增加.
点评 考查可逆反应以及从化学键对反应本质的理解,难度不大,注意可逆反应向正逆反应同时进行.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 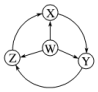 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
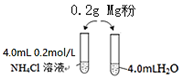 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于水的杀菌,消毒 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 目前加碘食盐主要添加的是KIO3 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
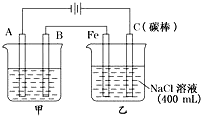 如图为相互串联的甲乙两电解池,试回答:
如图为相互串联的甲乙两电解池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值℃ | ||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com