
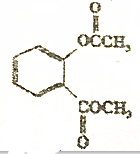
 在稀硫酸加热时反应的化学方程式
在稀硫酸加热时反应的化学方程式 +2H2O $?_{△}^{稀硫酸}$
+2H2O $?_{△}^{稀硫酸}$ +CH3COOH+CH3OH.
+CH3COOH+CH3OH. 科目:高中化学 来源: 题型:选择题
| A. | 植物油不能和H2发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质水解的最终产物为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3m+n)mol | B. | ($\frac{5m}{2}$+$\frac{n}{2}$-3p)mol | C. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol | D. | (3m+n+2p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Mg+2HCl→MgCl2+H2↑+Q(Q>0)分别在20℃和50℃进行 | |
| B. | 颗粒大小同的铁和镁分别与0.1mol/L的硫酸反应 | |
| C. | 同浓度同体积的Na2S2O3溶液分别与同体积的0.1mol/L、0.2mol/L的稀硫酸反应 | |
| D. | 其他条件相同时,硫分别在氧气和空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
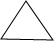 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
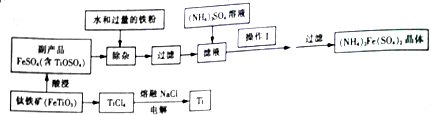
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室可用如图装置制取乙炔图中A管的作用是调节水面的高度来控制反应的发生和停止,制取乙炔的化学反应方程式为CaC2+2H2O→C2H2↑+Ca(OH)2
(1)实验室可用如图装置制取乙炔图中A管的作用是调节水面的高度来控制反应的发生和停止,制取乙炔的化学反应方程式为CaC2+2H2O→C2H2↑+Ca(OH)2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com