
【题目】“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。如下图是以天然气的主要成分为原料的合成路线流程图,其中“混合气体”的成分与水煤气相同;B的水溶液有防腐功能;D是C的钠盐,2 mol D分子间脱去1 mol H2分子可缩合生成E(草酸钠);H是F与A按物质的量之比为1∶2反应的产物。
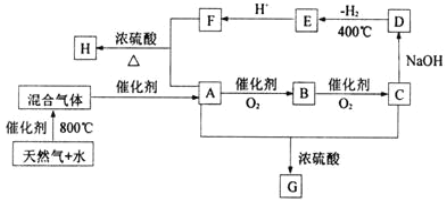
(1)天然气主要成分的电子式是________;E的化学式是________。
(2)G的结构简式是: _________。
(3)写出下列反应的化学方程式:
A―→B_____________________________;
A+F― →H__________________________。
【答案】(1) ;Na2C2O4;
;Na2C2O4;
(2)HCOOCH3;
(3)2CH3OH+O2![]() 2HCHO+2H2O;HOOC-COOH+2CH3OH
2HCHO+2H2O;HOOC-COOH+2CH3OH![]() CH3OOC-COOCH3
CH3OOC-COOCH3
【解析】
试题分析:天然气与水反应得到“混合物”的主要成分和水煤气的相同,则为CO和H2混合气在催化剂条件下得到A,A经氧化反应得到B,B氧化得到C,那么A为醇,B为醛,C为酸,已知B的水溶液有杀菌防腐能力,则A为甲醇,B为甲醛,C为甲酸,C和氢氧化钠反应生成D为HCOONa,2molD分子间脱去1molH2分子可缩合生成E,E为NaOOC-COONa, H是F与A按物质的量之比为1∶2反应的产物,则H为CH3OOCCOOCH3,A与C反应生成G为HCOOCH3,(1)天然气主要成分的主要成分是甲烷,甲烷的电子式是 ,E是草酸钠,其化学式是Na2C2O4;答案为:
,E是草酸钠,其化学式是Na2C2O4;答案为: ; Na2C2O4;
; Na2C2O4;
(2)G的结构简式为:HCOOCH3,答案为:HCOOCH3;
(3)A到B时甲醇被氧化为甲醛,反应的化学方程式为:2CH3OH+O2![]() 2HCHO+2H2O,A和F生H,即草酸和甲醇生乙二酸二甲酯,反应的化学式为:HOOC-COOH+2CH3OH
2HCHO+2H2O,A和F生H,即草酸和甲醇生乙二酸二甲酯,反应的化学式为:HOOC-COOH+2CH3OH![]() CH3OOC-COOCH3,答案为: 2CH3OH+O2
CH3OOC-COOCH3,答案为: 2CH3OH+O2![]() 2HCHO+2H2O; HOOC-COOH+2CH3OH
2HCHO+2H2O; HOOC-COOH+2CH3OH![]() CH3OOC-COOCH3
CH3OOC-COOCH3


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
【甲同学】 设计了如图1装置来一次性完成验证非金属性S>C>Si的实验研究;
【乙同学】 设计了如图2装置来验证卤族元素性质的递变规律。
A、B两处分别是浸有NaBr溶液的棉花、湿润的淀粉KI试纸,

(1)①甲同学设计实验的依据是 。
② A溶液的名称是 。
③ 烧杯中C发生反应的离子方程式为 。
(2)乙同学的实验原理是通过观察玻璃管中的实验现象,验证卤族元素性质的递变。
① 写出A处发生反应的离子方程式 。
② B处的实验现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | 最外层电子数是电子层数的3倍 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是__________;X的一种氢化物燃烧时火焰温度高,可以焊接金属,则该氢化物的结构式为 ;实验室制取该气体的化学方程式是 。
(2)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(3)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________(用元素符号表示)。实验室检验该微粒的方法是: 。
(4)T元素在周期表的位置: ,其简单阴离子的结构示意图: , 证明该粒子的还原性比Z— 强的离子方程式是 。硒(Se)是人体必需的微量元素,与T在同一主族,Se原子比T原子多一个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物的化学式为________。
(5)元素Z与氢氧化钠溶液反应的化学方程式为 ,其生成的含氧酸盐的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】Ⅰ煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g)+H2O (g)H2 (g)+CO2 (g)平衡常数K随温度的变化如下表
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)2CO (g)平衡常数K1
C(s)+H2O (g)H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是
A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的n(Cl-)= n(CH3COO-)相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修55:有机化学基础]聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类
高分子材料,在材枓的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
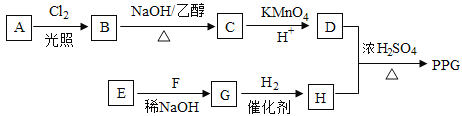
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④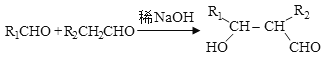 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写结构简式) :
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
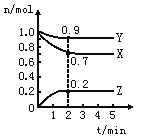
(1)该反应的化学方程式为 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均分子量比起始投料时_______ _____(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。(填序号)
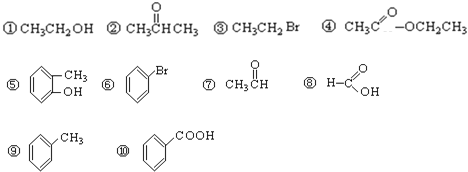
(1)芳香烃:__________; (2)卤代烃:__________;
(3)醇:__________; (4)酚:__________;
(5)醛:__________; (6)酮:__________;
(7)羧酸:__________;(8)酯:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com