
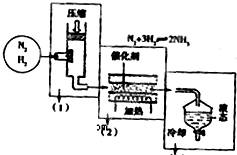
 海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源.食盐既是一种生活必需品,也是一种重要的工业原料.以食盐为原料可以得到多种产品.
海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源.食盐既是一种生活必需品,也是一种重要的工业原料.以食盐为原料可以得到多种产品.
| ||
| ||
| 22.4L |
| 22.4L/mol |
| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某硫酸试剂瓶标签上的内容:
如图是某硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu、Cu2+ |
| D、Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
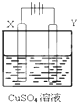 如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是( )
如图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是( )| X电极 | Y电极 | 通电后的变化 | |
| A | 石墨 | 石墨 | Y电极质量增加,溶液的pH增大 |
| B | 铁 | 铜 | 两电极的质量不发生变化 |
| C | 铜 | 铁 | X电极质量减小,Cu2+浓度不变 |
| D | 铁 | 铂 | Y电极:Fe2++2e-═Fe |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com