
| A.醋酸钠:CH3COOˉ+ H2O = CH3COOH + OHˉ |
B.硫化钾:S2ˉ+ 2H2O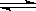 H2S +2 OHˉ H2S +2 OHˉ |
C.氯化铵: NH4+ + H2O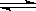 NH3·H2O + H+ NH3·H2O + H+ |
D.硫酸铁:Fe3+ +3 H2O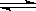 Fe(OH)3↓+3 H+ Fe(OH)3↓+3 H+ |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:不详 题型:填空题
 4分)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
4分)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。 L 0.01 mol/L NaHC2O4溶液中滴加10mL 0.01 mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接: ;
L 0.01 mol/L NaHC2O4溶液中滴加10mL 0.01 mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接: ;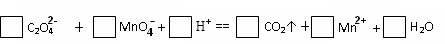
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl2、FeCl3 | B.NaHCO3、Na2CO3 |
| C.Al2(SO4)3、AlCl3 | D.NH4HCO3、NH4Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(HCOO-)>c(Na+) | B.c(HCOO-)<c(Na+) |
| C.c(HCOO-)=c(Na+) | D.无法确定c(HCOO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH- NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com