
| A、明矾用作净水剂 |
| B、液氨用作致冷剂 |
| C、漂粉精作消毒剂 |
| D、生石灰作干燥剂 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
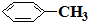 e.
e.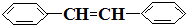 f.
f.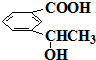
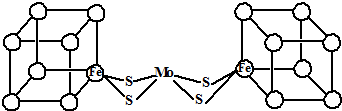
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性强弱:HClO>H2SO4>H2CO3 |
| B、热稳定性:HF>HCl>HBr |
| C、已知硒(Se)与硫同主族,其最高价氧化物对应的水化物分子式为:H2SeO3 |
| D、原子半径大小:Na>P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9 mol |
| B、1.2 mol |
| C、1.5 mol |
| D、1.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液中加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
| B、用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+═NO↑+I2+H2O |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
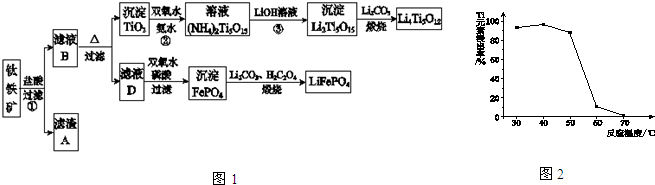
查看答案和解析>>
科目:高中化学 来源: 题型:
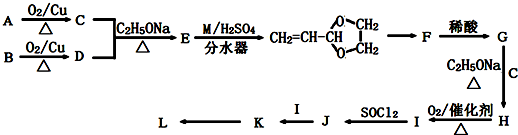
| C2H5ONa |
| △ |
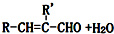
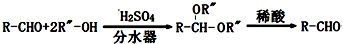
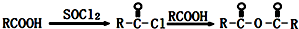
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ba2+、Fe3+、NO3-,通入SO2气体 |
| B、Ca2+、Cl-、K+、H+,通入CO2气体 |
| C、AlO2-、Na+、Br-、SO42-,通入CO2气体 |
| D、HCO3-、Na+、I-、HS-,加入AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
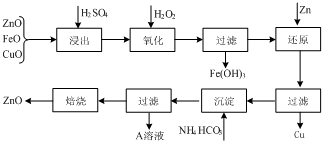
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com