
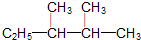 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;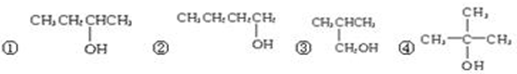
分析 (1)该有机物为烷烃,根据烷烃的系统命名法进行解答,注意选取的主链必须最长、支链编号之和必须最小;
(2)含有1个碳碳双键的烃为烯烃,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的;
(3)根据伯醇“(-CH2OH)”才能发生氧化反应生成醛,-CHOH只能被氧化为酮类,与羟基相连的C上无H原子则不能被氧化,据此结合选项回答即可.
解答 解:(1)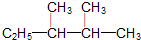 ,最长主链含有5个C,选取含有支链最多的碳链为主链,编号从右下方开始,在2、3号C各含有一个甲基,该有机物命名为:2,3-二甲基戊烷;
,最长主链含有5个C,选取含有支链最多的碳链为主链,编号从右下方开始,在2、3号C各含有一个甲基,该有机物命名为:2,3-二甲基戊烷;
故答案为:2,3-二甲基戊烷;
(2)分子中含有1个碳碳双键,所以该有机物属于烯烃,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,为己烯,分子核磁共振氢谱只有一个吸收峰,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的,满足条件的己烯的结构简式为:CH3C(CH3)=C(CH3)CH3;
故答案为:CH3C(CH3)=C(CH3)CH3;
(3)醇发生氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应.要发生生成醛的反应必须是“伯醇(-CH2OH)”,故②③可以被氧化为醛,①和④不能被氧化为醛;
故选D.
点评 本题综合考查了烷烃的命名、烯烃的结构,难度不大,掌握醇类氧化为醛的条件是解决本题的关键.


科目:高中化学 来源: 题型:解答题
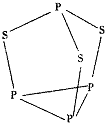 三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
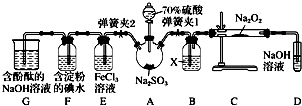
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的电子在同一区域里运动 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 处于最低能量的原子叫基态原子 | |
| D. | 同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
| Ⅰ | 1﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
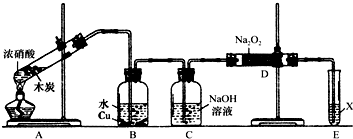
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | … | |
| R | 740 | 1500 | 7700 | 10500 | 13600 | … |
| A. | ①③ | B. | ②③ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
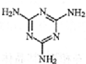 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )| A. | 形成的晶体熔点较高 | |
| B. | 一个分子中共含有15个σ键 | |
| C. | 属于极性分子,故极易溶于水 | |
| D. | 所有面原子采用sp2杂化,所有氮原子采用sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
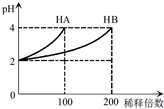 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com