
| A.在充电时,电池中c(H+)不断变小 |
| B.在充电时,蓄电池标有“—”的电极每通过2mol电子,将生成1mol PbO2 |
| C.在放电时,该电池的负极材料是铅板 |
| D.在放电时,正极发生的反应是:Pb(s) + SO42—(aq)= PbSO4(s) + 2e— |


科目:高中化学 来源:不详 题型:单选题
| A.5 : 2 | B.3 : 1 | C.15 : 2 | D.1 : 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O)(mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
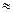 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。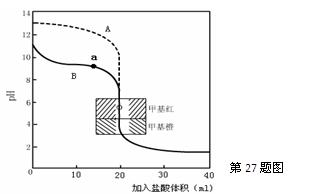
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.锌极上电极反应式为:Zn-2e-=Zn2+ |
| B.MnO2得电子被还原 |
| C.NH4+离子通过琼脂向锌极移动 |
| D.外线路中电流的方向从碳棒到锌片 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X极发生氧化反应,Y极发生还原反应 |
| B.工作一段时间后,KOH的物质的量减少 |
| C.该电池工作时通甲烷一极附近溶液的pH 升高 |
| D.在标准状况下通入5.6 L O2完全反应,则有1 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.阳极的电极反应式为:2Cl-→Cl2↑+2e- |
| B.阴极的电极反应式为:TiO2 + 4e-→Ti + 2O2- |
| C.通电后,O2-、Cl-均向阴极移动 |
| D.石墨电极的质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.充电时作阳极,放电时作正极 |
| B.充电时作阳极,发生氧化反应 |
| C.充电时作阴极,发生还原反应 |
| D.充电时作阴极,放电时作正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通H2的一极是正极,通O2的一极是负极? |
| B.通O2的一极是正极,通H2的一极是负极 |
| C.工作一段时间后电解质溶液pH增大? |
| D.工作时正极区附近pH减小? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com