
 Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 4 |
| 3 |
| 4 |
| 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģø£½ØŹ”ø£ÖŻČżÖŠøßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
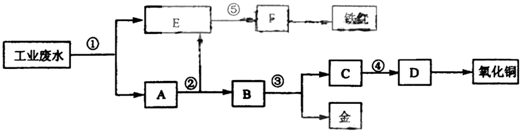
£Ø9·Ö£©Ä³³§µÄĖįŠŌ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠŅ»¶ØĮæµÄ”£Fe3+”¢Cu2+µČĄė×Ó”£ÓŠČėÉč¼ĘĮĖĶ¼ÖŠµÄ¹¤ŅÕĮ÷³Ģ£¬ĄūÓĆ³£ÓƵÄĖį”¢¼īŗĶ¹¤ŅµÉś²śÖŠµÄ·ĻĢśŠ¼£¬“Ó·ĻĖ®ÖŠÉś²śŅ»¶ØĮæµÄĢśŗģŗĶŃõ»ÆĶ”£
ĢīŠ“ĻĀĆęæÕ°×£ŗ
£Ø1£©Ķ¼ÖŠ±źŗÅ¢Ś“¦Šč¼ÓČėµÄĻąÓ¦ĪļÖŹŹĒ
£Ø2£©ČōŠčÖ¤Ć÷DČÜŅŗÖŠŹĒ·ńŗ¬ÓŠFe3+£¬ŠčŅŖŃ”ŌńµÄŹŌ¼ĮŹĒ £ØĢī»ÆѧŹ½£©”£
£Ø3£©Š“³ö¢Ł“¦·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
Š“³ö¢Ū“¦·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ĢśŗģµÄ»ÆѧŹ½ĪŖ £¬Š“³öĢśŗģŌŚ¹¤ŅµÉĻµÄŅ»ÖÖÖ÷ŅŖÓĆĶ¾ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2008ÄźĘÕĶØøßµČѧŠ£ÕŠÉśĶ³Ņ»æ¼ŹŌĄķ×ŪŹŌĢā»Æѧ²æ·Ö£ØÄžĻľķ£© ĢāŠĶ£ŗĢīæÕĢā
ij³§µÄĖįŠŌ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠŅ»¶ØĮæµÄFe3+”¢Cu2+”¢Au3+µČĄė×Ó”£ÓŠČĖÉč¼ĘĮĖĶ¼ÖŠµÄ¹¤ŅÕĮ÷³Ģ£¬ĄūÓĆ³£ÓƵÄĖį”¢¼īŗĶ¹¤ŅµÉś²śÖŠµÄ·ĻĢśŠ¼£¬“Ó·ĻĖ®ÖŠ»ŲŹÕ½š£¬²¢Éś²śŅ»¶ØĮæµÄĢśŗģŗĶŃõ»ÆĶ”£




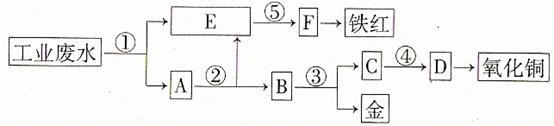
 ĢīŠ“ĻĀĆęæÕ°×”£
ĢīŠ“ĻĀĆęæÕ°×”£ £Ø1£©Ķ¼ÖŠ±źŗÅ“¦Šč¼ÓČėµÄĻąÓ¦ĪļÖŹ·Ö±šŹĒ¢Ł”””””””””””¢¢Ś”””””””””””¢¢Ū”””””””””””¢¢Ü”””””””””””¢¢Ż””””””””””£»
£Ø1£©Ķ¼ÖŠ±źŗÅ“¦Šč¼ÓČėµÄĻąÓ¦ĪļÖŹ·Ö±šŹĒ¢Ł”””””””””””¢¢Ś”””””””””””¢¢Ū”””””””””””¢¢Ü”””””””””””¢¢Ż””””””””””£» £Ø2£©Š“³ö¢Ł“¦·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½””””””””””””””””””””””””””””””””””””””””£»Š“³ö¢Ū“¦·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½””””””””””””””””””””””””””””””””””””””””””””””””””£»
£Ø2£©Š“³ö¢Ł“¦·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½””””””””””””””””””””””””””””””””””””””””£»Š“³ö¢Ū“¦·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½””””””””””””””””””””””””””””””””””””””””””””””””””£» £Ø3£©ĢśŗģµÄ»ÆѧŹ½ĪŖ””””””””””””””””””£»·Ö±šŠ“³öĢśŗģŗĶŃõ»ÆĶŌŚ¹¤ŅµÉĻµÄŅ»ÖÖÖ÷ŅŖÓĆĶ¾£ŗĢśŗģ””””””””””””””””””””””””””””””£»Ńõ»ÆĶ”””””””””””””””””””””””””””””””£
£Ø3£©ĢśŗģµÄ»ÆѧŹ½ĪŖ””””””””””””””””””£»·Ö±šŠ“³öĢśŗģŗĶŃõ»ÆĶŌŚ¹¤ŅµÉĻµÄŅ»ÖÖÖ÷ŅŖÓĆĶ¾£ŗĢśŗģ””””””””””””””””””””””””””””””£»Ńõ»ÆĶ”””””””””””””””””””””””””””””””£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com