
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间 | |
| C. | Na在Cl2中燃烧属于氧化还原反应,因为反应中有电子得失 | |
| D. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 |
分析 A.根据电离时生成的阳离子都是氢离子的化合物是酸;
B.根据胶体分散质粒子直径在1nm~100nm之间;
C.存在元素化合价变化的反应属于氧化还原反应;
D.有离子参加或生成的反应是离子反应.
解答 解:A.H2SO4是酸,因为H2SO4电离时生成的阳离子都是氢离子,故A错误;
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间,故B正确;
C.Na在Cl2中燃烧生成氯化钠,存在元素化合价变化,属于氧化还原反应,本质是反应中有电子得失,故C正确;
D.Na和H2O的反应是离子反应,因为反应中离子生成,故D错误;
故选BC.
点评 本题主要考查了物质的分类、离子反应的概念、胶体的概念等,难度不大,掌握分类的依据是解题的关键.


科目:高中化学 来源: 题型:解答题
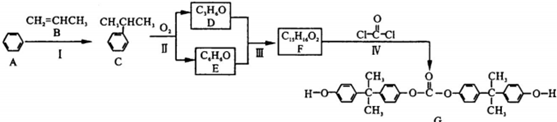
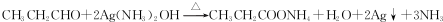 .
.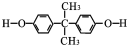 .
. 的反应合成航天用聚芳酯高分子,该化学反应方程式为
的反应合成航天用聚芳酯高分子,该化学反应方程式为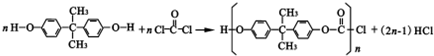 .
.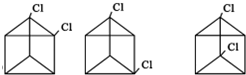 任意2种(任写两种).
任意2种(任写两种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
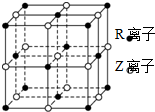 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3与CH4互为同系物 | |
| B. | 乙醇和乙酸都能与金属钠反应 | |
| C. | 正丁烷(CH3CH2CH2CH3)与异丁烷(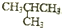 )互为同分异构体 )互为同分异构体 | |
| D. | 甲烷与苯在空气中燃烧的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com