
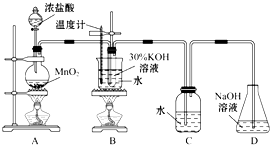
 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
分析 (1)过滤需要烧杯、漏斗、玻璃棒;
(2)若对调B和C装置的位置,C中盐酸抑制氯气的溶解,B中氯气与KOH加热生成氯酸钾;
(3)①研究反应条件对反应产物的影响,由表格数据可知,总体积相同,只有硫酸的浓度不同;
②实验为对比实验,1中为参照;
③反应生成碘,淀粉遇碘变蓝;
(4)利用氧化还原反应生成氯离子,利用硝酸银检验氯离子.
解答 解:(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤.该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
(2)若对调B和C装置的位置,C中盐酸抑制氯气的溶解,B中氯气与KOH加热生成氯酸钾,则可能提高氯酸钾的产率,故答案为:可能;
(3)①研究反应条件对反应产物的影响,由表格数据可知,总体积相同,只有硫酸的浓度不同,则实验目的为研究反应体系中硫酸浓度对反应产物的影响,
故答案为:研究反应体系中硫酸浓度对反应产物的影响;
②设计1号试管实验的作用是硫酸浓度为0的对照实验,故答案为:硫酸浓度为0的对照实验;
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入淀粉溶液显蓝色,故答案为:淀粉;
(4)由资料可知,设计简单实验为量取一定量的试样,加入足量的H2O2溶液,充分反应后,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得,
故答案为:量取一定量的试样,加入足量的H2O2溶液,充分反应后,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得.
点评 本题考查性质实验和含量测定实验,为高频考点,把握实验原理、实验技能及离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一列的元素都是金属元素 | |
| B. | 第三列所含的元素种类最多 | |
| C. | 第18列元素原子的最外层电子数均为8 | |
| D. | 只有第二列元素的最外层电子数为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸可以干燥H2、NH3、CO2等气体 | |
| D. | SO2的漂白原理与次氯酸相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
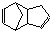 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中.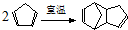 ,反应类型为加成反应;
,反应类型为加成反应;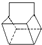 )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com