
 能量之间可以相互转化:原电池可将化学能转化为电能.
能量之间可以相互转化:原电池可将化学能转化为电能.分析 (1)能设计成原电池的反应必须是自发进行的放热的氧化还原反应;
(2)将2FeCl3+Fe═3FeCl2设计成原电池反应,则Fe为负极,正极可为碳棒等,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3.
解答 解:(1)能设计成原电池的反应应是能自发进行的氧化还原反应,①为中和反应,②为复分解反应,③为氧化还原反应,且反应放热,可设计成原电池,
根据分析可知,①②不属于氧化还原反应,无法设计成原电池,只有③满足条件,
故答案为:③;
(2)由方程式Fe+2FeCl3=3FeCl2可知,Fe被氧化,为原电池的负极,负极反应为:Fe-2e-=Fe2+,正极Fe3+被还原,电极方程式为:2Fe3++2e-=2Fe2+,负极电解质溶液为FeCl2,正极电解质溶液为FeCl3,原电池工作时,盐桥中的阴离子向负极移动,装置图为: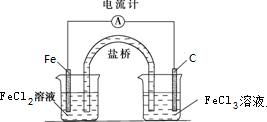 ,
,
故答案为: ;Fe3++e-=Fe2+;负极.
;Fe3++e-=Fe2+;负极.
点评 本题考查原电池的设计,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,题目难度中等,明确原电池的构成条件及反应必须是放热反应是解本题的关键,注意掌握原电池工作原理.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-l | 413 | 436 | 343 | 465 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36克水 | B. | 标准状况下的22.4升CO | ||
| C. | 含有7克N的HNO3 | D. | 常态下,500毫升0.5摩/升的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4溶液与BaCl2溶液 | B. | 铝片插入Hg(NO3)2溶液 | ||
| C. | NaNO3溶液与KCl溶液 | D. | Na2CO3溶液与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁屑溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | NaOH溶液中滴加少量Al2(SO4)3溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com