
分析 (1)传统的无机非金属材料是工业和基本建设所必需的基础材料,如玻璃、水泥等;新型无机非金属材料是20世纪中期以后发展起来的,具有特殊性能和用途的材料.它们是现代新技术、新产业、传统工业技术改造、现代国防和生物医学所不可缺少的物质基础,据此进行判断;
(2)磁铁矿的主要成分为四氧化三铁,根据电子守恒计算出生成铁的物质的量,再计算出生成铁的质量;写出硫化亚铁与氧化钙反应的化学方程式;
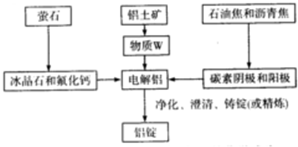
(3)冰晶石能溶解Al2O3晶体,被用作助熔剂降低Al2O3的熔点;W为铝土矿的主要成分氧化铝;设出生成铝锭的质量,然后利用铝元素质量守恒定律列式计算;
(4)牺牲阳极(金属Zn)的阴极保护法的“阴极”锌失去电子生成锌离子,据此写出电极反应式.
解答 解:(1)A.①采用甲烷为原料,在微波和其他条件下生产的金刚石为新型无机非金属材料,故①正确;
②采用传统方法用焦炭还原SiO2制备的单晶硅为新型无机非金属材料,故②正确;
③水泥是传统无机非金属材料,故③错误;
④光学玻璃是传统无机非金属材料,故④错误;
故答案为:①②;
(2)磁性氧化铁化学式为Fe3O4,其中铁元素的平均化合价为+$\frac{8}{3}$,该过程中转移的电子为1.60×105mol,则生成Fe的物质的量为:$\frac{1.60×1{0}^{5}mol}{\frac{8}{3}}$=6×104mol,可以得到生铁的质量为:56g/mol×6×104mol=3.36×106g=3.36t;通常用氧化钙除去硫,反应的化学方程式为:FeS+CaO$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CaS,
故答案为:3.36;FeS+CaO$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CaS;
(3)Al2O3属于离子晶体,熔点较高,加入冰晶石和氟化钙,熔融的冰晶石和氟化钙能溶解Al2O3晶体,所以其在电解冶炼铝时被用作助熔剂,降低三氧二化铝熔化时所需的温度,在金属铝的冶炼中加入冰晶石和氟化钙的目的是降低Al2O3的熔点,减少熔融电解质的能耗;W是铝土矿中主要成分氧化铝,其化学式为:Al2O3;
设生成的铝锭的质量为x,根据铝元素质量守恒可得:1.0t×60%×$\frac{27×2}{102}$×(1-3%)×(1-0.1%)×(1-2%)=99.9%x,解得:x=0.3t,
故答案为:降低Al2O3的熔点,减少熔融电解质的能耗;Al2O3;0.3;
(4)吸氧腐蚀中正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;阴极为原电池的负极,锌失去电子生成锌离子,电极反应式为:Zn-2e-=Zn2+,
故答案为:O2+2H2O+4e-=4OH-;Zn-2e-=Zn2+.
点评 本题考查了金属铝的冶炼、材料的判断、氧化还原反应的计算等知识,题目难度中等,注意掌握原电池工作原理,明确金属铝的性质及冶炼方法,还要熟悉传统无机非金属材料与新型无机非金属材料的区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.
如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主反应和副反应的还原剂都是HCl | |
| B. | 副反应中氧化剂和还原剂物质的量之比为1:4 | |
| C. | 盐酸的还原性与浓度有关,浓度越大还原性越强 | |
| D. | 为加快ClO2的生成速率,应选用较大浓度的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由SO2制亚硫酸钠:SO2$\stackrel{Na_{2}CO_{3}溶液}{→}$NaHSO3溶液$→_{调节溶液的pH}^{NaOH溶液}$Na2SO3溶液 | |
| B. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 | |
| C. | 由NH3制硝酸:NH3$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{20}}{→}$HNO3 | |
| D. | 由乙烯制乙酸:H2C=CH2$→_{催化剂}^{H_{20}}$CH3CH2OH$→_{△}^{Cu/O_{2}}$CH3CHO$→_{△}^{新制银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的酸性:w>Z>x | |
| B. | 化合物Q中存在两种类型的共价键 | |
| C. | Z、X都可以形成两种常见的酸性氧化物 | |
| D. | 四种元素的常见单质中X的单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com