
 写出下列反应的化学方程式
写出下列反应的化学方程式 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
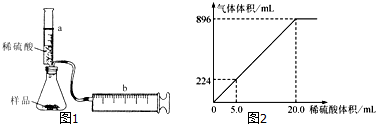
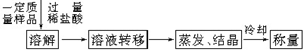
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中C、H、O个数之比为1:2:3 |
| B、分子中C、H个数之比为1:4 |
| C、分子中不可能含有氧原子 |
| D、此有机物的最简式为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com