
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水

已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
【答案】 启普发生器 b ih fg(或gf) kj l 增大气体与催化剂铁触媒的接触面积 该反应为可逆反应,反应物的转化率低,NH3中混有较多难溶于水的气体,装置F中不会产生倒吸 无水乙醇 [Ag(NH3)2]NO3 逐滴加入稀NaOH溶液至不再有沉淀生成,过滤,用适量蒸馏水洗涤,再将固体转移至小试管中,逐滴加入2%的稀氨水溶液至沉淀恰好溶解(其它合理答案均可)
【解析】I、(1)B中仪器名称是启普发生器;
⑵A中利用加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2,B中利用Zn与稀盐酸反应制氢气,通过E装置除去氢气混有的HCl气体,然后和N2通过C中浓硫酸干燥并混合后通入D中合成氨,再利用F装置中水吸收生成的氨气,氢气的尾气利用点火燃的方法除去,则装置从左到右接口的连接顺序是bceihfg(或gf) kj l;
⑶装置D中玻璃纤维上洒有催化剂接触媒,其作用是增大气体与催化剂铁触媒的接触面积;
⑷该反应为可逆反应,反应物的转化率低,NH3中混有较多难溶于水的气体,装置F中不会产生倒吸,则无需对该装置进行改进;
⑸②为防止白色固体溶解于水,可继续用无水乙醇洗涤;
③向溶液中逐滴加入稀盐酸产生沉淀,此沉淀为AgCl;取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色,说明溶液中含有NO3-;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体,说明溶液中含有NH4+,由此确定白色固体主要成分是[Ag(NH3)2]NO3;
⑹取2mL 2%的AgNO3溶液于洁净的小试管中,逐滴加入稀NaOH溶液至不再有沉淀生成,过滤,用适量蒸馏水洗涤,再将固体转移至小试管中,逐滴加入2%的稀氨水溶液至沉淀恰好溶解,即得到[Ag(NH3)2]OH溶液。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
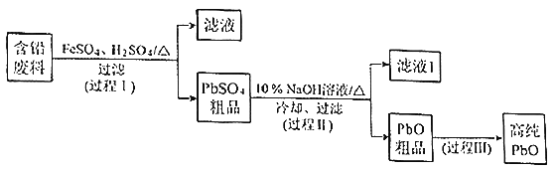
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
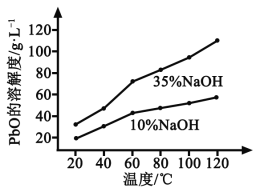
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质发生反应生成的气体分别通入FeCl2溶液,不能与FeCl2发生反应的是
A. CaO和浓氨水 B. 二氧化锰和浓盐酸共热
C. Na2O2和CO2 D. 铜片和浓硫酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用右图所示的实验装置进行实验。
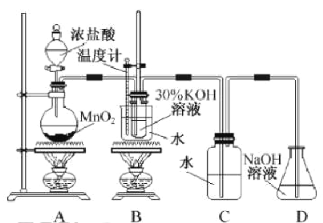
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
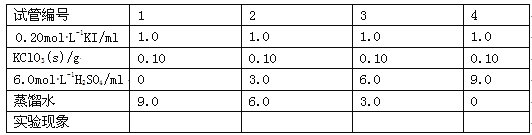
①系列a实验的实验目的是_______。
②设计1号试管实验的作用是___________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用右图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_____。(不考虑实验装置及操作失误导致不可行的原因)
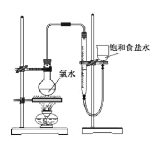
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操
作过程的细节):______
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是
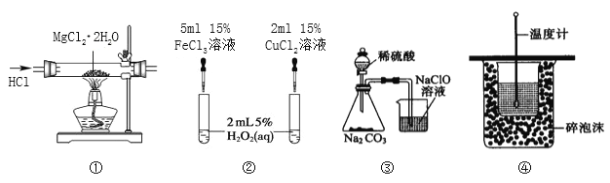
A. 实验①,制取无水MgCl2
B. 实验②,用于比较Fe3+和Cu2+对H2O2分解的催化效果
C. 实验③,验证酸性的强弱,H2SO4>H2CO3>HClO
D. 实验④,进行中和热的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列有关NH4HCO3和HCl反应的说法正确的是
A.NH4HCO3和HCl的反应是放热反应
B.NH4HCO3和HCl的反应是吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯氧化法制备苯甲酸的反应原理如下:
![]() + 2KMnO4
+ 2KMnO4![]()
![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() + HCl
+ HCl![]()
![]() +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

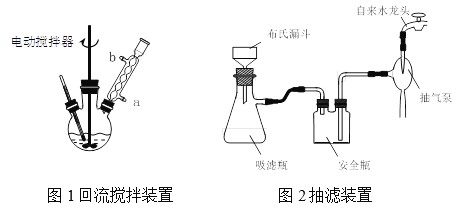
⑴实验室中实现操作Ⅰ所需的玻璃仪器有_____、烧杯;操作Ⅱ的名称为_____。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是__________;如图2所示抽滤完毕,应先断开_____之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com