
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值
D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定
【知识点】实验的设计和实验操作 J1 H1 H3
【答案解析】C 解析:A、测定相同浓度的NaCl溶液和Na2S溶液的pH值,只能说明HCl和H2S的酸性强弱,无法比较Cl与S元素的非金属性强弱,因为元素非金属性的强弱可以通过比较它们最高价氧化物的水化物酸性强弱得到,故A错误;B、如果用坩埚钳夹持Mg条点燃后迅速投入上述集气瓶底部会造成集气瓶炸裂,操作错误,故B错误;C、用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值,根据碱性的强弱可以得到HA和HB两种弱酸的相对强弱从而得到Ka的相对大小,故C正确;D、操作复杂,设计不合理,可以通过检验碳酸根离子的存在得到NaOH溶液放置空气中是否部分转化为Na2CO3,故D错误。
故答案选C
【思路点拨】本题考查了实验的设计和实验操作,实验设计要简单易行、科学合理。


科目:高中化学 来源: 题型:
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
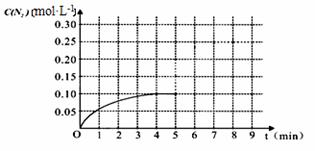
①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式 。
②以下是对硝酸型酸雨的评价,其中正确的是 (用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式________
___________________________________________________________________。
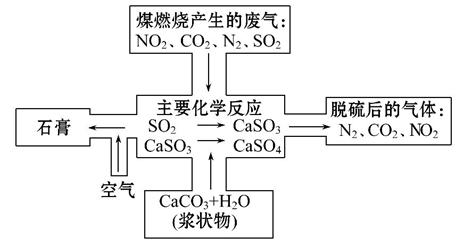
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称) ,它对环境的负面影响是 。
(4)检验脱硫后废气中是否含有SO2的简单方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究SO2的漂白作用到底是SO2本身还是SO2与水作用的产物,某学习小组设计了如图装置来进行实验。请回答相关问题。
(1)制备SO2气体的反应方程式为: ;
发生装置的玻璃仪器名为 、 ;
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。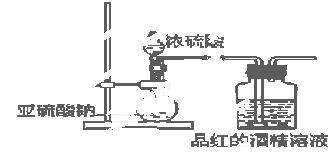
① ;② ;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) 。
(4)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,对此他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由是 。
(5)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,再分别一次性加入20ml 0.1mol/L的Na2SO3溶液、20ml 0.1mol/L的NaHSO3溶液,发现加入Na2SO3溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容:
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面_________ | 较上面_______ | 较上面_______ | 慢 |
②根据实验和分析,得出的结论是
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00 mL溶液A。
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.582 5 g。
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.02 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。回答下列问题:
(1)①不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) :
A、在溶解过程中有少量液体溅出烧杯外
B、定容时仰视仪器上的刻度线
C、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
(2) ③中配好的KMnO4溶液置于 (“酸式”或“碱式”)滴定管,判断滴定终点的实验现象是
(3)通过计算确定样品的组成 (写出简单计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
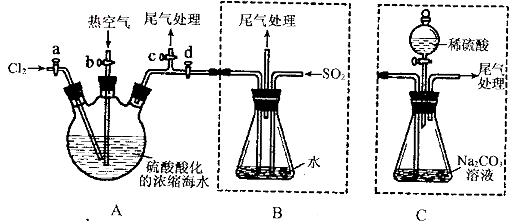
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
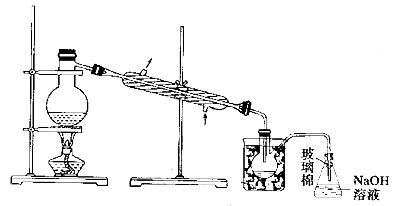
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A.【物质结构与性质】
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
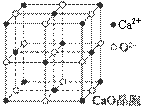

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.44.2 kJ·mol-1
C.-330 kJ·mol-1 D.330 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com