
【题目】下列关于C60、H3、O2-、N5+等微粒的叙述错误的是
A. 碳、氢、氧、氮元素各含有不同核素
B. H3与H2化学性质相同,互为同位素
C. C60与N5+中都含有共价键
D. KO2属于含有共价键的离子化合物
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
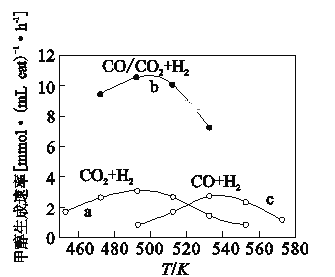
①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2![]() CO
CO![]() CH3OH II.CO
CH3OH II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______(用文字说明)。
②NO的来源是______(用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:
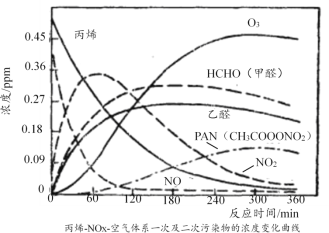
①下列说法正确的是_____(填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______(注:每消耗1molO3,同时生成1molO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有KOH和Ca(OH)2的混合溶液,c(OH﹣)=0.1 molL﹣1。取此溶液500 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112 mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )

A. 560、672 B. 1008、1120 C. 2240、2352 D. 392、504
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与铁相似,金属锡能与盐酸反应生成氯化亚锡(SnCl2),氯化亚锡又能被氯化铁氧化为氯化锡(SnCl4)。则下列有关粒子氧化性和还原性强弱的比较中,正确的是
A.氧化性:Sn4+<Sn2+B.氧化性:Fe3+<Sn4+
C.还原性:Fe2+<Sn2+D.还原性:Fe<Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。
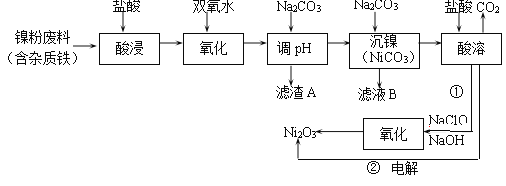
请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
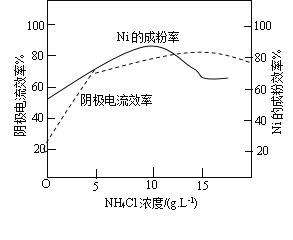
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序的步骤顺序正确的是( )
①观察物质的外部特征
②实验和观察
③解释和结论
④预测物质的性质
A.①④②③B.①②③④C.②①③④D.①④③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com