
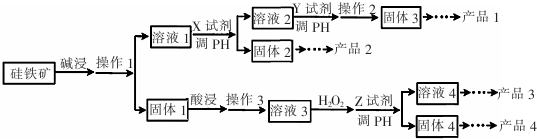
分析 硅铁矿中主要含Si02、Fe304、Al203、Cu0,由工艺流程可知,硅铁矿用碱浸,Si02、Al203能溶解在碱溶液中,生成硅酸盐和偏铝酸盐,过滤得固体1为Fe304、Cu0,溶液1为硅酸盐和偏铝酸盐溶液,溶液1中加入过量的盐酸可得固体2为硅酸,最后可得产品2为硅胶,过滤得溶液2为氯化铝溶液,加入氨水调节pH值,可得固体3为氢氧化铝沉淀,经过系列过程可得铝,固体1用硫酸酸浸可得含有铁离子、亚铁离子、铜离子的溶液,加入双氧水将亚铁离子氧化成铁离子,调节pH值,使铁离子生成氢氧化铁沉淀,所以过滤后得固体4为氢氧化铁,氢氧化铁加热分解可知产品4为铁红,溶液4中含有硫酸铜,经过系列操作可得产品3为胆矾晶体,据此解答.
解答 解:硅铁矿中主要含Si02、Fe304、Al203、Cu0,由工艺流程可知,硅铁矿用碱浸,Si02、Al203能溶解在碱溶液中,生成硅酸盐和偏铝酸盐,过滤得固体1为Fe304、Cu0,溶液1为硅酸盐和偏铝酸盐溶液,溶液1中加入过量的盐酸可得固体2为硅酸,最后可得产品2为硅胶,过滤得溶液2为氯化铝溶液,加入氨水调节pH值,可得固体3为氢氧化铝沉淀,经过系列过程可得铝,固体1用硫酸酸浸可得含有铁离子、亚铁离子、铜离子的溶液,加入双氧水将亚铁离子氧化成铁离子,调节pH值,使铁离子生成氢氧化铁沉淀,所以过滤后得固体4为氢氧化铁,氢氧化铁加热分解可知产品4为铁红,溶液4中含有硫酸铜,经过系列操作可得产品3为胆矾晶体,
(1)碱浸时,Si02、Al203能溶解在碱溶液中,发生的离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O、Si02+2OH-=Si032-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O、Si02+2OH-=Si032-+H2O;
(2)为提高碱浸的浸出率,可采取的方法有将矿石粉碎改用热的碱液增大碱的浓度等,
故答案为:将矿石粉碎改用热的碱液增大碱的浓度等;
(3)根据分析可知,溶液3中加H2O2的目的是 将Fe2+氧化成Fe3+以便沉淀完全,对应的离子反应方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:将Fe2+氧化成Fe3+以便沉淀完全;2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)Z试剂的主要作用是调节pH值,与酸反应,同时注意要不引入新的杂质,故选bcd;
(5)由硫酸铜溶液中获得硫酸铜晶体,要蒸发浓缩,使液体表面出现晶膜再冷却结晶,故选B;
(6)判断溶液4中铁离子沉淀完全的方法是取少量溶液4加KSCN溶液不出现红色,
故答案为:取少量溶液4加KSCN溶液不出现红色.
点评 本题为工艺流程题,考查了方程式的书写、物质分离的方法、离子的检验等,理解工艺流程是解题的关键,需要学生根据工艺流程提取信息,对学生综合运用能力和推理有较高的要求,难度中等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液加入过量的氨水:Al3++4NH3•H2O═[Al(OH)4]-+4 NH4+ | |
| B. | 氯化亚铁溶液通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合:NH4++OH-═NH3↑+H2O | |
| D. | 铁与稀盐酸;2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 将Na2O2放入H2O中:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| C. | 向NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将稀盐酸与84消毒液混合:C1-+C1O-+2H+═C12↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将少量酸溅到眼中,应立即用水洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 酒精着火时,可用湿抹布将其扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
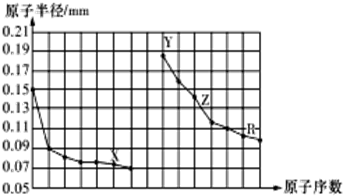
| A. | 同周期元素中,X氢化物的沸点最高 | |
| B. | 简单离子半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集干燥纯净的NH3 | |
| B. |  用装置丁分离乙酸乙酯和饱和碳酸钠溶液 | |
| C. |  用于制备并收集少量NO2 | |
| D. |  比较MnO2、Cl2、S的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 常温下将5mL 0.1 mol/LNa2S2O3溶液、5mL 0.01 mol/LNa2S2O3溶液分别与5mL 0.1 mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com