
【题目】1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热△H为
A.-Y kJ/molB.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/molD.+(10X-Y) kJ/mol
【答案】B
【解析】
碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2,3.6g碳的物质的量为
CO2,3.6g碳的物质的量为![]() =0.3mol,6.4g的氧气的物质的量为
=0.3mol,6.4g的氧气的物质的量为![]() =0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-
=0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-![]() =-(5X-0.5Y)kJ/mol,故选B。
=-(5X-0.5Y)kJ/mol,故选B。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】钴是熔点高的金属,可与氯气反应制氯化钴![]() ,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
,氯化钴易潮解,可用于催化剂的制备、氨的吸收等。制备氯化钴的装置如图所示。
已知:![]() 的氧化性强于
的氧化性强于![]() 。
。
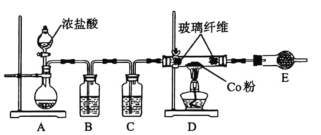
(1)检查![]() 装置气密性的方法:用止水夹夹住
装置气密性的方法:用止水夹夹住![]() 、
、![]() 之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置
之间的橡皮管,向分液漏斗中加水,________(将步骤补充完整),证明装置![]() 气密性良好。
气密性良好。
(2)装置![]() 烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
烧瓶中的固体为漂粉精,烧瓶中发生反应的化学方程式________。
(3)装置![]() 的洗气瓶中盛放的试剂是________,装置
的洗气瓶中盛放的试剂是________,装置![]() 硬质玻璃管中的玻璃纤维的作用是________。
硬质玻璃管中的玻璃纤维的作用是________。
(4)![]() 中物质的名称________,其作用是________。
中物质的名称________,其作用是________。
(5)钴有多种氧化物,![]() 与浓盐酸反应的离子方程式是________。
与浓盐酸反应的离子方程式是________。
(6)氯化钴溶液与氯化铝溶液类似,直接蒸干不能得到![]() 固体,使氯化亚砜
固体,使氯化亚砜![]() 与
与![]() 混合加热可以得到氯化钴固体,原因是________。
混合加热可以得到氯化钴固体,原因是________。
(7)向氯化钴溶液中加入草酸钠![]() ,生成草酸钴晶体
,生成草酸钴晶体![]() ,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的
,将草酸钴晶体在空气中充分加热,将反应生成的气态物质通人澄清石灰水中生成沉淀的质量为的![]() ,剩余固体为钴的某种氧化物,其质量为
,剩余固体为钴的某种氧化物,其质量为![]() ,计算确定钴的氧化物的化学式是________。
,计算确定钴的氧化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
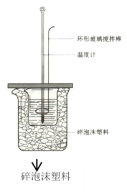
A.如图所示,测定中和热时,大小两烧杯间填满碎泡沫的作用是固定小烧杯
B.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1硫酸充分反应,两反应测定的中和热不相等
C.加入NaOH溶液的正确操作是一次迅速加入
D.若用50mL 0.55mo1·L-1的氢氧化钠溶液与50mL 0.25 mol/L硫酸溶液反应测得中和热,NaOH溶液稍过量是没必要的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺为无色液体,还原性强,易被氧化,有碱性,与酸反应生成盐,硝基苯与氢气制备苯胺(沸点为184℃)的反应原理如下:
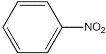 +3H2
+3H2![]()
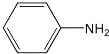 +2H2O
+2H2O
某同学设计的制备实验装置(部分夹持装置省略)如图:
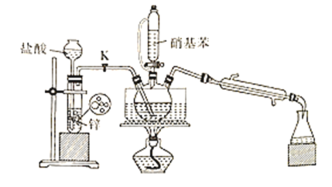
下列说法正确的是( )
A.仅用上述装置图中仪器就可以完成该实验
B.用硝酸代替盐酸,反应速率更快,实验效果较好
C.点燃酒精灯前,打开K,先通一段时间的H2
D.三颈烧瓶内的反应结束后,关闭K,先在三颈烧瓶中加入浓硫酸后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
2NH3(g)ΔH=-92.4 kJ·mol-1,在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ。(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 由
由![]() 与
与![]() 组成的混合物中所含的质子总数为
组成的混合物中所含的质子总数为![]()
B.![]() 和
和![]() 所含的氢原子数均为
所含的氢原子数均为![]()
C.![]() 溶液在沸水中生成的胶体粒子数为
溶液在沸水中生成的胶体粒子数为![]()
D.![]() 乙醇与
乙醇与![]() 乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为
乙酸在浓硫酸的作用下充分反应,生成乙酸乙酯的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g)![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是 ( )
A.c(X2)=0.15mol·L-1B.c(Y2)=0.9mol·L-1
C.c(Z2)=0.3mol·L-1D.c(Q2)=0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. Pt为阴极,Cu为阳极
B. b极的电极反应式是2H++2e-=H2↑
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com