
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,能使紫色石蕊试剂先变红后褪色,也可用pH试纸测量其pH值 |
分析 A、氯气在化学反应中既可以做氧化剂,还可以做还原剂;
B、氧化性越强得电子后还原性越弱;
C、氯气不易溶于饱和食盐水,所以可以用排饱和食盐水的方法收集氯气;
D、氯气与水反应生成盐酸和次氯酸,所以氯水具有盐酸、HClO的性质.
解答 解:A、氯气在和水以及强碱的反应中既做氧化剂,还做还原剂,故A错误;
B、氧化性越强得电子后还原性越弱,所以还原性Cl-<Br-<I-,故B错误;
C、氯气和水反应生成盐酸和次氯酸,饱和食盐水中含有氯离子,所以饱和食盐水抑制氯气溶解,则可以采用排饱和食盐水的方法收集氯气,故C正确;
D、氯水中含有氢离子,能使pH试纸变红,由于氯水中次氯酸具有漂白性,故pH试纸后褪色,故D错误;
故选C.
点评 本题考查卤素原子的结构及其性质,为高频考点,侧重于学生的分析能力和,注意把握物质的性质的异同,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝是地壳中含量最多的金属元素 | |
| B. | 在常温下,铝不能与浓硫酸反应 | |
| C. | 铝是一种比较活泼的金属 | |
| D. | 在化学反应中,铝容易失去电子,是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 氢氧化钠 | C. | 氢氧化钡 | D. | 氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
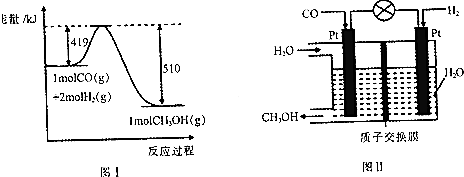
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量(mol) | 3 | 2 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 溶液中不一定含有SO42- |
| B | 向装有Fe(NO3)2溶液试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Be+ |
| D | 向淀粉溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2溶液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入物质 | HCl(aq) | FeCl3 | NaOH | CH3COONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α4>α2 | B. | α4>α2>α5>α3>α1 | C. | α2>α4>α5>α1>α3 | D. | α1>α3>α5>α2>α4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 氢氟酸具有酸性,可用于雕刻玻璃 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | NH3具有还原性,可用NH3与灼热CuO作用制取少量N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com