
| A. | 2mol/L的Na2CO3溶液中Na+个数为4NA | |
| B. | 2L 0.5mol/LCH3COOH溶液中含有的H+数为NA | |
| C. | 含2mol溶质的浓硫酸与足量的Cu反应转移的电子数为2NA | |
| D. | 1L 2mol/L的K2CO3溶液中CO32-个数小于2NA |
分析 A.溶液体积未知;
B.醋酸为弱酸,部分电离;
C.铜只能与浓硫酸反应,与稀硫酸不反应,随着反应的进行,浓硫酸变成稀硫酸,反应停止;
D.碳酸根离子为弱酸根离子,溶液中部分发生水解.
解答 解:A.溶液体积未知,无法计算碳酸钠溶液中钠离子个数,故A错误;
B.2L 0.5mol/LCH3COOH溶液中含有的H+数小于NA,故B错误;
C.铜与浓硫酸的反应中,消耗2mol硫酸会生成1mol二氧化硫,由于随着反应的进行,浓硫酸变成稀硫酸,铜与稀硫酸不反应,所以转移电子数小于2NA,故C错误;
D.碳酸根离子为弱酸根离子,溶液中部分发生水解,所以1L 2mol/L的K2CO3溶液中CO32-个数小于2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意铜与硫酸反应的条件、注意盐类水解、弱电解质的电离方式,题目难度中等.


科目:高中化学 来源: 题型:解答题
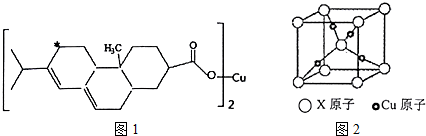
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
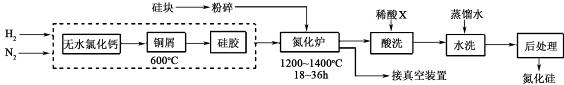
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
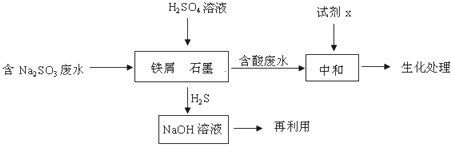
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
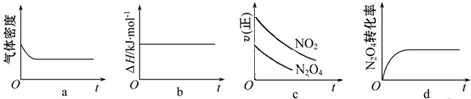
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
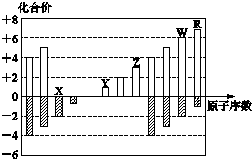
| A. | 离子半径:Z>Y>X | |
| B. | 最高正价氧化物对应的水化物的酸性:R<W | |
| C. | 氢化物的还原性:R>W | |
| D. | R的单质能与W的氢化物反应,可证明非金属性:R>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CH3COO-、CO32-、OH- | B. | K+、Al3+、SO42-、AlO2- | ||
| C. | Na+、K+、SO32-、Fe3+ | D. | NH4+、H+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com