
【题目】25℃,几种物质的pH和浓度如下表所示.回答下列问题:

(1)c1___(填“>“'<C”或“=“)c2.
(2)溶液中水的电离程度②___(填“>“'<”或“=“)③.
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为___(填序号).
(4)①溶液与④溶液等体积混合,溶液的pH___(填“>“'<“或“=”,下同)7;用④溶液滴定①荣而言,滴定过程中不可能出现的结果是___
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
【答案】>=①>②>④>③>C
【解析】
氢氧化钠在溶液中完全电离,所以pH等于11氢氧化钠溶液中c(OH-)=c(NaOH)=10-3mol/L,而一水合氨为弱碱,存在电离平衡,所以pH等于11氨水溶液,c(氨水)>10-3mol/L;同理,氯化氢在水中完全电离,pH等于3盐酸溶液,c(H+)= c(HCl)=10-3mol/L,而醋酸为弱电解质,部分发生电离,c(醋酸)>10-3mol/L;据以上分析进行解答。
(1)氢氧化钠为一元的强碱,pH等于11,c(H+)=10-11mol/L, c(OH-)= c(NaOH)=10-3mol/L,氨水为一元弱碱溶液,存在电离平衡,因此氨水溶液的pH等于11,氨水的浓度大于氢氧化钠溶液的浓度,即c1> c2;综上所述,本题答案是:>。
(2)酸、碱抑制水的电离,溶液中氢离子浓度或氢氧根离子浓度越大,抑制程度越大,醋酸溶液的pH=3,溶液中c(H+)=10-3mol/L;对氢氧化钠溶液的pH等于11,c(OH-)=10-3mol/L,二者对水的电离程度抑制能力一样,即②=③;综上所述,本题答案是:=。
(3)氢氧化钠溶液pH=11,c(OH-)=10-3mol/L,盐酸溶液的pH=3,c(H+)=10-3mol/L,分别加水稀释10倍,氢氧化钠溶液pH=10,盐酸溶液的pH=4;氨水溶液pH=11,c(OH-)=10-3mol/L,醋酸溶液的pH=3,c(H+)=10-3mol/L,二者为弱电解质,存在电离平衡,加水稀释,电离程度增大,因此,分别加水稀释10倍,醋酸溶液的pH<4,氨水溶液pH>10;所以稀释后四种溶液的pH由大到小的顺序为:①>②>④>③;综上所述,本题答案是:①>②>④>③。
(4)pH=11的氨水和pH=3的盐酸溶液等体积混合,由于一水合氨为弱电解质,存在电离平衡,因此氨水的浓度大于盐酸溶液的浓度,二者反应后,氨水过量,溶液显碱性,pH>7;用盐酸溶液滴定氨水,溶液中存在电荷守恒:c(NH4+)+ c(H+)= c(OH-)+ c(Cl-),如果c(OH-)>c(H+),则c(NH4+)>c(Cl-);如果c(OH-)=c(H+),则c(NH4+)=c(Cl-);如果盐酸过量较多,还会出现:c(Cl-)>c(H+)>c(NH4+)>c(OH-);结合上述分析,只有C选项不可能出现;综上所述,本题答案是:>, C。


科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是()
A. CH3CH=CHCH3分子中的四个碳原子可能在同一直线上
B. 淀粉和纤维素属于多糖, 均可在在人体内水解转化为葡萄糖,为人类提供能量
C. 分子式为 C4H8O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D. 分枝酸结构简式如图 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.晶体硅可制作太阳能电池的芯片B.稀硝酸可以用铝槽来运输
C.氧化铁可用来制作红色油漆和涂料D.用镁铝合金可作飞机制造材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D. 1mol 苯中含有碳碳双键的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气、水体污染的治理是化学工作者研究的重要课题,燃煤的烟道气和汽车尾气是造成雾霾天气污染的原因之一。
(1)用CH4催化还原氮氧化物,已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ/mol,欲计算反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1)的焓变△H2,则还需要查找某化合反应的焓变△H3,该化合反应中各物质化学计量数之比为最简整数比时△H3=bkJ/mol,则该化合反应的热化学方程式为____________________。据此计算出△H2=__________kJ/mol(用含a和b的式子表示)。
(2)汽车尾气转化的反应之一:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g) △H=-746.5kJ/mol。在某温度时,可按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表:
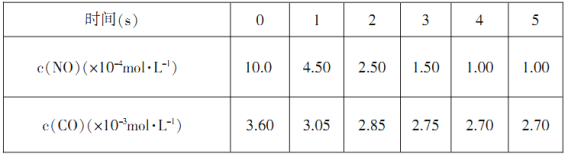
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率υ(N2)=______________________________。
②在该温度下,反应的平衡常数K=___________(只写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明___________(填字母)。
A.该反应的反应物混合后很不稳定
B.在催化剂的作用下,该反应一旦发生将在较短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式为______________________。
(4)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标淮:镍低于1.1×10-5mol·L-1,铜低于7.8×10-5mol·L-l。则需要控制溶液中S2-的浓度不低于__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
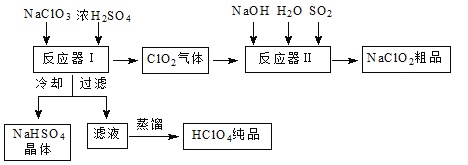
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是_________________________。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有________________,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:

(1)钠元素位于周期表第______周期______族。
(2)NaNH2中氮元素的化合价为_______;Na+的结构示意图为_____。
(3)NaOH的电子式为______。
(4)反应NH4NO3![]() N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
(5)反应①的化学方程式为______。
(6)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为______(N3-被氧化为N2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是
A. 4L 0.5mol/LNaCl溶液 B. 1L 0.3mol/LNa2SO4溶液
C. 5L 0.4mol/LNaOH D. 2L 0.15mol/LNa3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com