
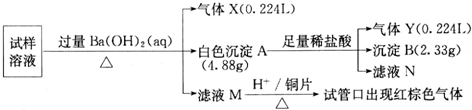
| 0.224L |
| 22.4L/mol |
| 2.33g |
| 233g/mol |
| 0.224L |
| 22.4L/mol |
| 0.224L |
| 22.4L/mol |
| 2.33g |
| 233g/mol |
| 0.224L |
| 22.4L/mol |
| 0.224L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
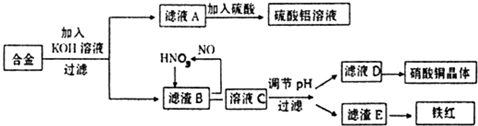
查看答案和解析>>
科目:高中化学 来源: 题型:
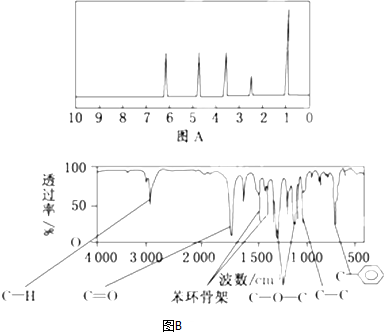
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中 加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
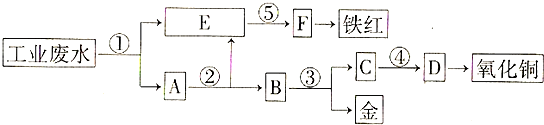
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H3PO4 | K1=7.11×10-3 |
| H3PO3 | K1=3.7×10-2 | K2=6.23×10-8 | |
| K2=2.9×10-7 | K3=4.5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
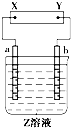 图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )
图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )| a电极 | b电极 | X电极 | 溶液 | 所加物质 | |
| A | 锌 | 石墨 | 负极 | CuSO4 | CuO |
| B | 石墨 | 石墨 | 负极 | NaOH | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 | CuO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
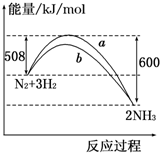
| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com