
| 硅酸盐 | 化学组成 | 氧化物形式 |
| 高岭土 | Al2(Si2O5)(OH)4 | |
| 正长石 | K2Al2Si6O16 | |
| 红柱石 | Al2SiO5 | |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.H2CO3比H2SiO3受热易分解 |
B.高温下能发生反应Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑ |
| C.CO2能溶于水生成碳酸,而SiO2却不溶于水 |
| D.CO2通入Na2SiO3溶液中有胶状沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiC是一种新型无机非金属材料,任何条件下都不可能在空气中燃烧 |
B.制造粗硅时的反应:2SiO2+5C Si+SiC+4CO↑ Si+SiC+4CO↑ |
| C.Si、SiO2能用NaOH溶液分离 |
| D.纯净的SiO2只能用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2O3和CO2是同素异形体 | B.C2O3和CO燃烧产物都是CO2 |
| C.C2O3和CO都是酸性氧化物 | D.C2O3和CO2都是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.氯化氢通入碳酸钠溶液中放出气体,通入硅酸钠溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O |
| B.透闪石中Mg元素的质量分数是Ca元素质量分数的1.5倍 |
| C.1 mol Ca2Mg5Si8O22(OH)2与足量的盐酸作用,至少需要14 mol HCl |
| D.透闪石是一种新型无机非金属材料,难溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-116 kJ·mol-1
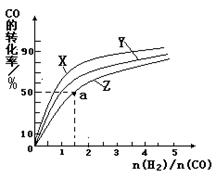
CH3OH(g) △H1=-116 kJ·mol-1| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
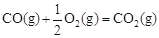 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1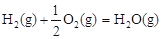 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com