
分析 (1)由信息可知,FeSO4、HNO3发生氧化还原反应,生成N2O、Fe(NO3)3、Fe2(SO4)3、H2O,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+1价,配平的反应为24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O;
(2)Fe元素的化合价升高,失去电子,N元素的化合价升高,得到电子;
(3)硝酸为氧化剂,结合N元素的化合价变化计算转移电子.
解答 解:(1)由信息可知,FeSO4、HNO3发生氧化还原反应,生成N2O、Fe(NO3)3、Fe2(SO4)3、H2O,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+1价,配平的反应为24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O,
故答案为:24FeSO4+30HNO3=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O;
(2)Fe元素的化合价升高,失去电子,发生氧化反应,则发生氧化反应的物质为FeSO4,N元素的化合价升高,得到电子,则N元素被还原,
故答案为:FeSO4;N;
(3)0.5mol 氧化剂得到电子为0.5mol×(5-1)=2mol,故答案为:2.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
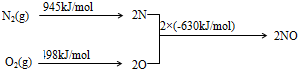
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 化学变化能够实现一种原子变为另一种原子 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
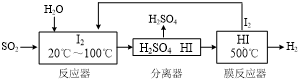
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

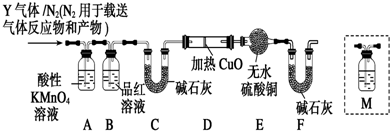
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
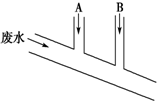 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用石灰石和盐酸反应制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液反应:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
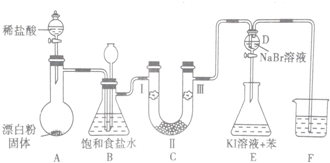
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com