
 .
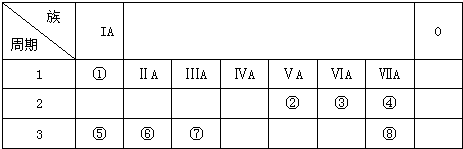
.分析 由元素在周期表中的位置可知①~⑧分别为H、N、O、F、Na、Mg、Al、Cl,
(1)非金属性最强的为F,原子核外有2个电子层,最外层电子数为7;
(2)元素的金属性越强,对应的最高价氧化物的碱性越强;
(3)①介于金属和非金属分界线的元素可用于做半导体材料;
②Ga和As的化合价分别为+3价、-3价,以此判断化学式;
(4)①金属Be和Al单质及化合物性质相似,Be和氢氧化钠反应生成BeO22-和氢气;
②BeCl2溶液与氢氧化钠溶液反应,先生成沉淀,后溶解.
解答 解:由元素在周期表中的位置可知①~⑧分别为H、N、O、F、Na、Mg、Al、Cl,
(1)非金属性最强的为F,原子核外有2个电子层,最外层电子数为7,则原子结构示意图为 ,故答案为:F;
,故答案为:F; ;
;
(2)金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的碱性越强,应为NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(3)①介于金属和非金属分界线的元素可用于做半导体材料,题中Si、Ge符合,故答案为:C;
②Ga和As的化合价分别为+3价、-3价,形成的化合物为GaAs,故答案为:GaAs;
(4)①金属Be和Al单质及化合物性质相似,Be和氢氧化钠反应生成BeO22-和氢气,离子方程式为Be+2OH-=BeO22-+H2↑,故答案为:Be+2OH-=BeO22-+H2↑;
②BeCl2溶液和MgCl2溶液可以用氢氧化钠溶液鉴别,BeCl2先生成沉淀,后溶解,故答案为:NaOH溶液.
点评 本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,有利于基础知识的巩固,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 →
→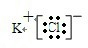 .
.| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.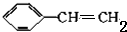 +HBr$\stackrel{一定条件下}{→}$
+HBr$\stackrel{一定条件下}{→}$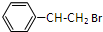 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
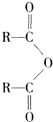 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
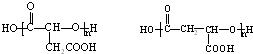 (一种即可).
(一种即可).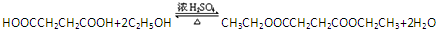 .
. .Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式:
.Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: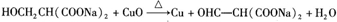 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
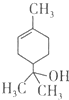
| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com