
下图为短周期的一部分,Y原子最外层电子数
是其电子层数的2倍,下列说法正确的是( )
A.Y的氢化物比Z的氢化物稳定
B.原子半径大小顺序是X >Y>R
C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物的酸性最强的是Y

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2 + bCl2+eC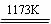 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg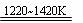 Ti+2MgCl2 Ⅱ
Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
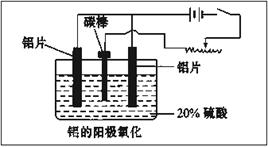
(3)下列说法正确的是 。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
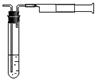
某化工厂设计要求为:空气中二氧化硫含量不得超过0.02 mg·L-1。
某同学拟用下图所示简易装置测定空气中的SO2含量:准确移取10mL 5×10-4 mol·L-1的标准碘水溶液,注入试管中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止。假设该同学的测量是准确的,则他抽气的次数至少为 次时方可说明该厂空气中的SO2含量达标。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素离子aA2+、bB+、cC3-、dD-都具有相
同电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是 ( )
A. A、B、C、D、E B. E、C、D、B、A C. B、A、D、C、E D. C、D、A、B、E
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其他成分未列出)。
| 编号 | 名称 | 主要成分 |
| ① | 绿矾 | FeSO4·7H2O |
| ② | 醋精 | CH3COOH |
| ③ | 苏打 | Na2CO3 |
| ④ | 酒精 | CH3CH2OH |
| ⑤ | 铜导线 | Cu |
| ⑥ | 蔗糖 | C12H22O11 |
| ⑦ | 烧碱 | NaOH |
(1)请你对表中①~⑦的主要成分进行分类(填编号)。
属于盐的是________,属于电解质的是________,属于非电解质的是________。
(2)写出②与⑦反应的化学方程式:______________________________________
______________________。
过量盐酸与③反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

 现有下列物质:①Na2CO3•10H2O晶体 ②锌 ③氯化氢 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硫酸 ⑩熔融NaCl ⑾ 蔗糖 (1)按物质的分类方法填写表格的空白处 (填编号) :
现有下列物质:①Na2CO3•10H2O晶体 ②锌 ③氯化氢 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硫酸 ⑩熔融NaCl ⑾ 蔗糖 (1)按物质的分类方法填写表格的空白处 (填编号) :
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
|
 (2)上述物质中有物质之间在溶液中可发生离子反应:H++OH-══H2O,写出一个该离子反应对应的化学方程式
(2)上述物质中有物质之间在溶液中可发生离子反应:H++OH-══H2O,写出一个该离子反应对应的化学方程式
(3)将⑨滴加到⑦中至过量的实验现象是
(4)将③通入⑧中至恰好完全反应,则溶液导电能力的变化为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com