

分析 (1)实现固体和液体的分离用过滤的方法,亚铁离子易被氧气氧化;
(2)TiOSO4水解生成TiO2•xH2O和硫酸;由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,溶液B为硫酸铵溶液;
(3)根据沉淀溶解平衡的移动以及碳酸根离子乳酸之间反应的原理来回答;
(4)酸性高锰酸钾氧化硫酸亚铁时,Mn由+7价变为+2价,亚铁离子被氧化为铁离子,高锰酸根离子与亚铁离子物质的量之比为1:5,结合原子守恒配平;亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,则 5 FeSO4•7H2O~KMnO4,令FeSO4•7H2O的质量分数为x,根据关系式列方程计算.
解答 解:(1)实现固体和液体的分离用过滤的方法,亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,
故答案为:过滤;防止Fe2+被氧化;
(2)TiOSO4水解生成TiO2•xH2O和硫酸,化学方程式为:TiOSO4+(x+1)H2O?TiO2•xH2O+H2SO4,由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,溶液B为硫酸铵溶液,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,
故答案为:TiOSO4+(x+1)H2O?TiO2•xH2O+H2SO4;Fe2++2HCO3-=FeCO3↓+H2O+CO2↑;
(3)碳酸亚铁的沉淀存在溶解平衡:FeCO3(s)?Fe2+(aq)+CO32-(aq),加入乳酸,这样CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,
故答案为:FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(4)酸性高锰酸钾氧化硫酸亚铁时,Mn由+7价变为+2价,亚铁离子被氧化为铁离子,高锰酸根离子与亚铁离子物质的量之比为1:5,结合原子守恒配平,该反应的离子方程为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,则
5 FeSO4•7H2O~KMnO4,
5×278g 1mol
ag×x 0.1000mol/L×0.02L×$\frac{100mL}{20mL}$
所以5×278g:ag×x=1mol:0.1000mol/L×0.02L×$\frac{100mL}{20mL}$
解得x=$\frac{13.9}{a}$,
故答案为:5、1、8、5、1、4H2O;$\frac{13.9}{a}$.
点评 本题是化学工艺流程题目,是一道金属元素的单质以及化合物性质的综合应用题目,涉及对原理的理解、实验条件下的选择与控制、物质的分离提纯、氧化还原反应、平衡移动原理等,考查学生分析和解决问题的能力,难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | 氧化铝具有高熔点,可用于生产耐火砖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:R<Y<Z | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
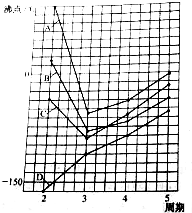 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
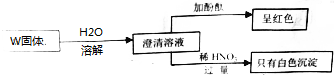
| A. | 一定不存在③⑥ | B. | 可能存在①② | C. | 一定存在①④⑦ | D. | 至少存在④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
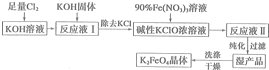

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
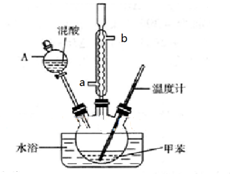
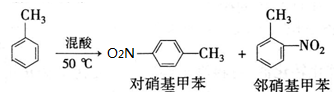
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构式:N≡N | |
| B. | 氯元素的原子结构示意图: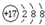 | |
| C. | 中子数为79、质子数为55 的铯(Cs)原子${\;}_{55}^{79}$Cs | |
| D. | 二氧化碳的电子式: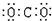 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com