
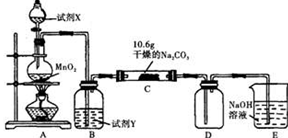
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2: | |
| 步骤3: | |
| | |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2:向A试管中滴加足量BaCl2溶液(1分) | 若无明显现象,则C固体中不含Na2CO3(1分)若溶液变浑浊,则C固体中含Na2CO3(1分) |
| 步骤3:向B试管中滴加足量稀硝酸,再加适量 AgNO3溶液(1分) | 若无明显现象,则C固体中不含NaCl(1分)若溶液变浑浊,则C固体中含NaCl(1分) |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 | 无明显现象 |
| 步骤2:向A试管中滴加BaCl2溶液 | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| 实验步骤 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有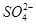 |
| B.向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
C.将某气体通入品红溶液中,品红溶液褪色,该气体一定是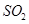 |
| D.将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质一定属于醛类 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.HCl | C.NaOH | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 操 作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B.水的沸点为100oC,酒精的沸点为78.5oC,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C.四氯化碳和水混合后,可用分液的方法来分离 |
| D.NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com