
| A. | Na2SO3 和NaHSO3 | B. | Na2SO3 和NaOH | C. | Na2SO3 | D. | NaHSO4 |
分析 n(SO2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,二氧化硫如果生成亚硫酸氢钠需氢氧化钠的物质的量为:0.075mol,如果生成亚硫酸钠,需氢氧化钠的物质的量为:0.15mol,而1mol•L-1的NaOH溶液100mL中,n(NaOH)=1mol•L-1×0.1L=0.1mol,氢氧化钠的物质的量介于0.075mol~0.15mol之间,由此分析解答.
解答 解:n(SO2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,二氧化硫如果生成亚硫酸氢钠需氢氧化钠的物质的量为:0.075mol,如果生成亚硫酸钠,需氢氧化钠的物质的量为:0.15mol,而1mol•L-1的NaOH溶液100mL中,n(NaOH)=1mol•L-1×0.1L=0.1mol,氢氧化钠的物质的量介于0.075mol~0.15mol之间,所以产物是Na2SO3和NaHSO3的混合物,故选A.
点评 本题考查混合物有关计算,注意利用极限法进行解答,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl | |
| B. | CH2=CH2+HOCl$\stackrel{催化剂}{→}$HOCH2-CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | 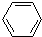 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O反应类型是消去反应.由F生成G的化学方程式
+H2O反应类型是消去反应.由F生成G的化学方程式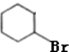 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr反应类型是取代反应.G发生催化氧化的化学方程式2
+NaBr反应类型是取代反应.G发生催化氧化的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置A是电解池,装置B是原电池 | |
| B. | 装置A是原电池,装置B是电解池 | |
| C. | 电子由装置A中碳棒流向装置B中碳棒 | |
| D. | 工作一段时间后,A装置中稀H2SO4溶液质量减轻,B装置中CuCl2质量减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 钠和水反应:2Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| D. | 放出下层液体后,再从漏斗下端口放出上层液体. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钾溶液(碳酸钾)--适量硫酸溶液 | |
| B. | 氯化钠溶液(氯化镁)--适量氢氧化钠溶液 | |
| C. | 氯化钾固体(二氧化硅)--适量氢氧化钾溶液 | |
| D. | 氯气(氯化氢气体)--适量的饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com