
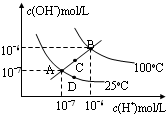
| A. | 图中四点Kw间的关系:A=D<C<B | |
| B. | 若从A点到D点,可采用:温度不变在水中加少量酸 | |
| C. | 若从A点到C点,可采用:温度不变在水中加少量NaAc固体 | |
| D. | 若从A点到D,可采用:温度不变在水中加少量NaAc固体 |
分析 A、AD都处于250C时,Kw相等,根据c(H+)和c(OH-)的大小,Kw=c(H+)•c(OH-)来比较大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、从A点到C点c(H+)和c(OH-)的变化以及Kw只受温度影响来分析;
D、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变化,据此回答.
解答 解:A、A、D、E都处于25℃时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且E点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D,故A正确;
B、若从A点到D点,加酸,c(H+)变大,c(OH-)变小,温度不变,Kw不变化,故B正确;
C、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,但在25℃时在水中加入适量的醋酸钠固体,c(H+)变小,c(OH-)变大,Kw不变,故C错误;
D、加少量NaAc固体,c(H+)变小,c(OH-)变大,温度不变,Kw不变化,和图象不符,故D错误.
故选CD.
点评 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小是做题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
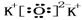 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阴极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
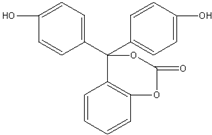 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正向移动 | B. | 逆向移动 | ||
| C. | 不移动 | D. | 无法确定移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com