
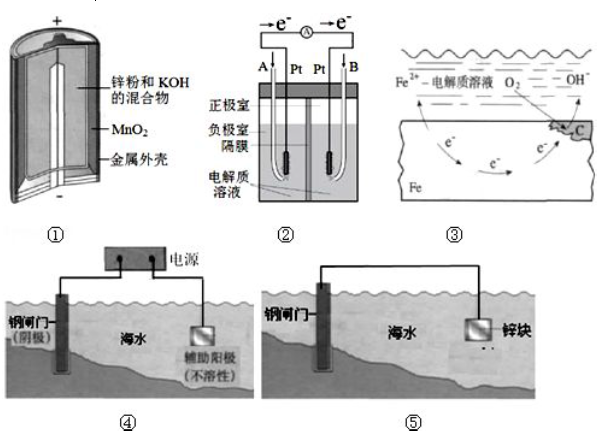
分析 (1)原电池中,正极失去电子发生氧化反应,负极得到电子发生还原反应,进行进行分析;
(2)燃料电池中,得到电子的一极为正极,失去电子的一极为负极,根据图示可知,B得到电子,电极反应为氧气得到电子与氢离子结合生成水;
(3)钢铁的吸氧腐蚀中,氧气得到电子生成氢氧根离子;
(4)金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析解答;
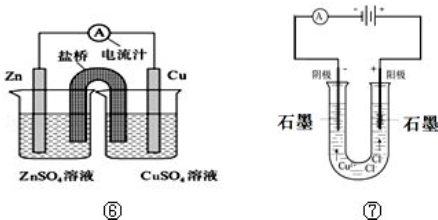
(5)锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,原电池工作时,电子由负极经外电路流向正极,盐桥中阳离子向正极移动,阴离子向负极移动,据此进行解答;
(6)图⑦为惰性电极电解氯化铜溶液,阳极氯离子失去电子生成氯气,检验氯气通常使用湿润的淀粉KI试纸.
解答 解:Ⅰ.(1)碱性锌猛电池中,Zn为负极,MnO2为正极,正极得到电子发生还原反应,
故答案为:MnO2;还原;
(2)图②是酸性电解质的氢氧燃料电池,B极得到电子,则B为正极,正极氧气得到电子,其电极反应是:O2+4H++4e-═2H2O,
故答案为:O2+4H++4e-═2H2O;
(3)钢铁的吸氧腐蚀中,负极金属失去电子发生氧化反应,正极氧气得到电子生成氢氧根离子,正极的电极反应式为:2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
(4)图⑤中钢闸门连接锌,铁、锌、海水构成原电池,Fe失电子能力小于Zn而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法;
图④中右边为辅助阳极,则钢闸门为阴极,阴极连接的是电源的负极;故答案为:⑤;负;
Ⅱ.(5)该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,电池反应式为:Zn+Cu2+=Zn2++Cu;原电池工作时,电解质溶液中的阳离子向正极移动,阴离子向正极移动,则盐桥中Cl-会移向移向左边,
故答案为:Zn+Cu2+═Cu+Zn2+;左;
(6)图⑦中用石墨电极电解氯化铜溶液,阴极铜离子得到电子生成铜,阳极氯离子放电生成氯气,检验氯气的方法为:将湿润的淀粉KI试纸放在阳极产生气体处,试纸变蓝,
故答案为:将湿润的淀粉KI试纸放在阳极产生气体处,试纸变蓝.
点评 本题考查了原电池、电解池的工作原理,题目难度中等,明确原电池、电解池的工作原理及其应用方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物成分 | 提纯试剂 | 离子方程式 |
| ①FeCl2溶液(FeCl3) | ||
| ②FeCl3溶液(FeCl2) | ||
| ③Na2CO3溶液(NaHCO3) | ||
| ④Fe2O3(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴Ba(OH)2溶液,恰好使SO42-沉淀完全:2H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| D. | 过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
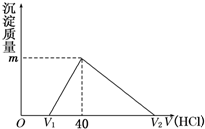 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是( )| A. | 图中m值为1.56 g | B. | 标准状况下产生氢气896 mL | ||
| C. | 图中V2为60 mL | D. | 原合金质量为0.92 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com