
| A. | 仅②③⑥ | B. | 仅④⑤⑥ | C. | 仅①④ | D. | 仅②⑥ |
分析 单质是只有一种元素组成的纯净物,化合物是至少两种元素组成的纯净物,据此解答.
解答 解:①由同种元素组成的物质可能是混合物,例如臭氧与氧气组成物质,故错误;
②只有纯净物才具有固定的熔沸点,故正确;
③同分异构体之间是由相同种类和相同数目的原子组成的分子,是混合物,例如乙醇与甲醚,故错误;
④钠和氧形成的化合物有2种,如氧化钠和过氧化钠组成的物质,属于混合物,故错误;
⑤碳元素存在多种同素异形体,金刚石、石墨、C60,燃烧产物都为二氧化碳,组成的物质属于混合物,故错误;
⑥同种微粒构成的是纯净物,故正确;
故选:D.
点评 本题考查纯净物和混合物的区别,明确概念的内涵是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 实验室用如图装置制取少量溴苯,试填写下列空白.
实验室用如图装置制取少量溴苯,试填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
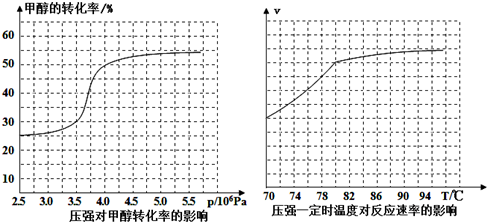
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 1使溴的四氯化碳溶液褪色;②比例模型为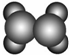 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为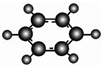 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为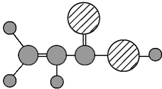 |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$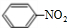 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面 | |
| D. | 用精密pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com