
 .
.
分析 (1)CO与NO反应,生成无毒气体为氮气和二氧化碳;
(2)①反应速率=$\frac{△c}{△t}$;
②结合平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
③依据化学平衡移动原理分析选项,改变条件,平衡向减弱这种改变的方向进行;
④反应前后气体体积减小,若其它条件不变,将0.5mol NO、2mol CO投入2L容器进行反应,相当于原来的平衡状态减小压强,平衡浓度减小,反应速率减小,平衡向气体体积增大的分析进行;
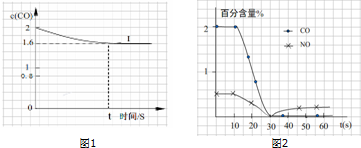
(3)汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用;
解答 解:(1)由NO、CO相互反应转换成无毒的气体,即生成氮气和二氧化碳,该反应的化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6mol,依据化学平衡三段式列式计算:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 0.5 2 0 0
变化量(mol) 0.4 0.4 0.2 0.4
平衡量(mol) 0.1 1.6 0.2 0.4
①前20s内平均反应速率v(NO)=$\frac{\frac{0.4mol}{1L}}{20s}$=0.02mol•L-1•S-1;
故答案为:0.02mol•L-1•S-1;
②体积为1L,物质的量数值为浓度数值,计算得到平衡常数K=$\frac{0.2×0.{4}^{2}}{0.{1}^{2}×1.{6}^{2}}$=1.25;
故答案为:1.25;
③A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率减小,故A错误;
B.反应是气体体积减小的反应,缩小容器的体积,压强增大,平衡将向右移动,故B正确;
C.催化剂对正逆反应速率影响程度相同,在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂,故C正确;
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,浓度商Q=$\frac{1×0.{4}^{2}}{0.{1}^{2}×{2}^{2}}$=4>K,平衡逆向进行,则此时v正<v逆 ,故D错误;
故答案为:AD;
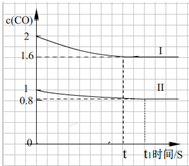
④若其它条件不变,将0.5mol NO、2mol CO投入2L容器进行反应,浓度减小一半,若平衡不动,得到c(CO)浓度应为0.8mol/L,但恒温恒容条件下,将0.5mol NO、2mol CO投入2L容器,减少压强,平衡逆向进行,一氧化碳浓度应略高于0.8mol/L,起点一氧化碳浓度为1mol/L;终点的时间比t长;c(CO) 比0.8略高些,画出的图象为: ;
;
故答案为: ;
;
(3)汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线变化分析,开始的气体含量变化不大,说明温度低,催化剂的作用未起作用;证明反应未达到催化剂工作温度(或尚未达到反应的温度);
故答案为:尚未达到催化剂工作温度(或尚未达到反应的温度).
点评 本题考查了化学方程式的书写方法,化学平衡的计算分析判断,平衡常数和转化率,反应速率的概念的计算应用,图象分析应用是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | NO2、CO、NO都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氢氧化钠溶液,纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
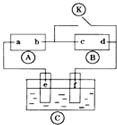 如图
如图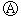 为直流电源,
为直流电源,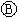 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,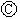 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现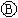 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. |  中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
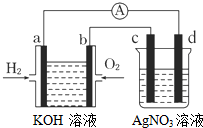 氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )| A. | a电极是负极,OH-移向正极 | |
| B. | b电极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 燃料电池中电解质溶液的pH保持不变 | |
| D. | d电极有气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com