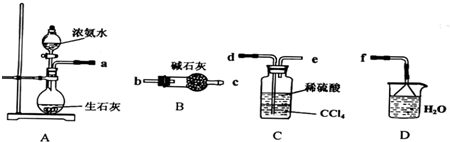
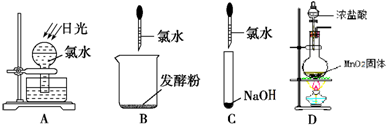
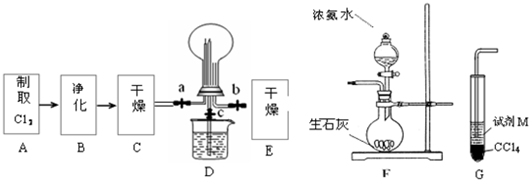
(1)①浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、氯气和水MnO
2+4H
++2Cl
- Cl
2↑+Mn
2++2H
2O;在D装置中,应用一个方程式判断出Cl
2、Fe
3+、I
2的氧化性强弱,根据氧化剂的氧化性大于氧化产物的氧化性,加入碘化亚铁溶液,氯气先把碘离子氧化成碘单质,再把二价铁离子氧化成三价铁离子,所以看到的现象是:先观察到下层CCl
4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色.
故答案为:MnO
2+4H
++2Cl
- Cl
2↑+Mn
2++2H
2O;FeI
2;先观察到下层CCl
4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色.
②氯气是黄绿色的气体,氯气和氨气能生成氯化氢气体,氯化氢和氨气相遇立即生成白烟氯化铵,所以看到的现象是黄绿色气体消失,产生白烟;烧瓶内气体反应后压强减小,烧瓶内外导致产生压强差,所以烧杯中的水进入烧瓶产生喷泉.
故答案为:黄绿色气体消失,产生白烟;烧杯中的液体进入烧瓶中,形成喷泉.
③要使分液漏斗中的液体顺利流下,应使分液漏斗内外产生压强差,外界大气压产生的压强导致溶液流下,所以正确操作是将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下.
故答案为:将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下.
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质.
A、虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误.
B、氢氧化钠没有氧化性,故B错误.
C、氯水有强氧化性,且不造成干扰,故C正确.
D、碘化钾有还原性没有氧化性,故D错误.
故选C.
②氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子Cl
2+SO
32-+H
2O=2Cl
-+SO
42-+2 H
+.
故答案为Cl
2+SO
32-+H
2O=2Cl
-+SO
42-+2 H
+.
③由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥.
故答案为:过滤、洗涤、干燥.
④二氧化硫和二氧化碳都能使澄清的石灰水变浑浊,但二氧化硫具有还原性,能使酸性高锰酸钾褪色,要想检验碳酸根离子,首先要排除亚硫酸根离子的干扰,再将气体通入澄清的石灰水,若石灰水变浑浊,则证明废水中含有CO
32-,否则没有.
故答案为:向废水中加入足量的盐酸,将生成的气体先通入足量的 酸性KMnO
4溶液,再通入澄清石灰水,若紫色KMnO
4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO
32-.




 名校课堂系列答案
名校课堂系列答案