
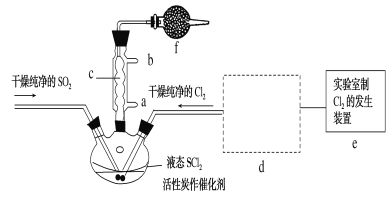
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
【答案】A MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气 饱和食盐水 浓硫酸 蒸馏 BaCl2或KSCN或K3[Fe(CN)6]溶液
Mn2++Cl2↑+2H2O 防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气 饱和食盐水 浓硫酸 蒸馏 BaCl2或KSCN或K3[Fe(CN)6]溶液
【解析】
(1) 从反应原理、原料的利用率及能源消耗等角度分析;
(2)二氧化锰与浓盐酸再加热条件下反应生成MnCl2、氯气与水;
(3) SOCl2遇水会发生水解反应,Cl2、SO2有毒,会污染空气;
(4)装置d干燥氯气,且除去HCl;
(5)氯化亚砜沸点为77℃,Cl2的沸点为50℃,所以采用分馏的方法即可将之分离;
(6) 若发生氧化还原反应,则Fe3+被还原为Fe2+,而SOCl2水解得到的SO2被氧化为H2SO4。
(1)A中反应生成硫酸钾、二氧化硫和水制取二氧化硫比较合理;B中18.4mol/L的硫酸太浓,其中水分过少硫酸仍以分子形式存在,无法与铜反应制取二氧化硫;C中无论是浓硝酸还是稀硝酸都具有强氧化性可将+4价硫氧化为+6价,无法得到二氧化硫;D中加热亚硫酸氢钠确实会产生二氧化硫,但也同时产生水,所以向下倾斜试管不合理;故答案为:A;
(2)实验室利用二氧化锰和浓盐酸混合加热制氯气,发生的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)f作用为防止空气中水蒸气进入冷凝管,产品变质,同时吸收SO2、Cl2,防止污染空气,故答案为:防止空气中的水蒸气进入冷凝管,使产品变质,同时吸收尾气SO2、Cl2,防止污染空气;
(4)装置e中产生Cl2含有水、HCl,则小框内包含一个盛装饱和食盐水的洗气瓶除去HCl,一个盛装浓硫酸的干燥装置;故答案为:饱和食盐水;浓硫酸;
(5)已知氯化亚砜沸点为77℃,SCl2的沸点为50℃,则采用蒸馏的方法将其分离,故答案为:蒸馏;
(6)若发生氧化还原反应,则Fe3+被还原为Fe2+,而SOCl2水解得到的SO2被氧化为H2SO4,实验证明脱水时发生氧化还原反应方案为:方法一:往试管中加水溶解,滴加BaCl2溶液,若产生白色沉淀,则证明脱水过程发生了氧化还原反应;方法二:往试管中加水溶解,检验是否生成Fe2+或检验Fe3+是否存在,即加入K3[Fe(CN)6]检验Fe2+或加入KSCN检验Fe3+是否存在,故答案为:BaCl2或KSCN或K3[Fe(CN)6]溶液。


科目:高中化学 来源: 题型:
【题目】佛罗那可用于治疗新生儿高胆红素血症。以甲苯为原料制备佛罗那的合成路线如图:
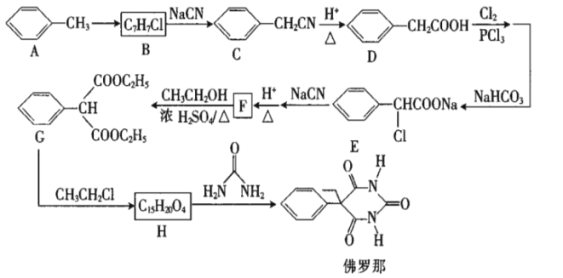
回答下列问题:
(1)D的名称是__,B中官能团的名称为__。
(2)写出H的结构简式:__。
(3)结构中不含碳碳双键,有六个碳原子在同一条直线上的B的同分异构体的结构简式有__种(不考虑立体异构),写出其中一种结构的结构简式:__。
(4)上述合成路线中有字母代号的物质中有手性碳原子的是__(填字母代号)。(已知:连有四个不同的原子或原子团的碳原子称为手性碳原子)
(5)H→佛罗那的反应类型为__。
(6)写出F→G的化学方程式:__。
(7)参照上述合成路线,设计以丙二酸、乙醇和氯乙烷为原料合成乙基丙二酸的合成路线__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素![]() 和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下
和W的原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下![]() 的B溶液的
的B溶液的![]() ,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
,气体A和气体B相遇产生白烟,X与Z可按原子个数比1∶1形成化合物C。下列说法正确的是( )
A.化合物C可能为离子化合物
B.Z离子的半径比Y离子的大
C.Y的非金属性很强,其单质非常活泼
D.氧化物的水化物的酸性:Y比W强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,X气体与Y气体反应生成Z气体。反应过程中,反应物与生成物的物质的量浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
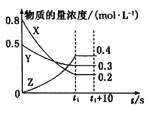
A.该反应的化学方程式为3X+Y=2Z
B.t1-(t1+10)s时,瞬时速度v(X)=v(Y)=0
C.0-t1s时反应物X的转化率为60%
D.0ls内X的反应速率为v(X)=![]() mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
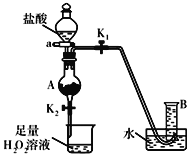
A.烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.B中收集到的气体是氢气
D.反应后的烧杯中通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。河水01是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和溉溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1molL-1的NaOH溶液中,由水电离出的c(OH-)=___molL-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___。
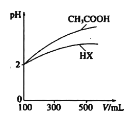
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___(填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
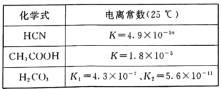
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为____。
②向NaCN溶液中通人少量的C02,发生反应的化学方程式为___。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___molL-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐渐加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如下图所示.下列说法不正确是
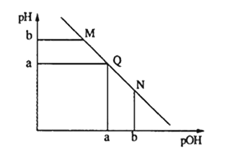
A. M点和N点溶液中H2O的电离程度相同
B. Q点溶液中,c(NH4+)+c(NH3·H2O)=c(Cl-)
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量a—非兰烃,其相对分子质量为 136。根据如下转化,回答相关问题。
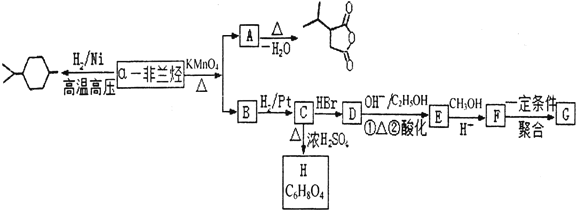
已知:Ⅰ. ![]()
![]()
![]() +RCOOH
+RCOOH
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ.2CH3COOH![]()
![]()
(1)a—非兰烃的结构简式为______。
(2)B 中含有的官能团名称为______,C→D 的反应类型为______。
(3)C→H 的反应方程式为______。
(4)写出符合下列条件 A 的同分异构体______(写三种即可)。
①含有 4 个—CH3②1mol 此同分异构体在碱性条件下水解需 2mol NaOH。
(5)以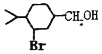 为原料合成
为原料合成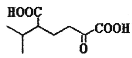 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com