
【题目】下列说法或表示法正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ·mol-1
B.当反应物的总能量比生成物的总能量高时,为吸热反应;当生成物的总能量比反应物的总能量高时,则为放热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含lmolNaOH的溶液混合,放出的热量等于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
【答案】D
【解析】
A. 燃烧热是1mol可燃物完全燃烧放出的能量,CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为: CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1,故A错误;
O2(g)=CO2(g) △H=-283.0kJ·mol-1,故A错误;
B. 当反应物的总能量比生成物的总能量高时,为放热反应;当生成物的总能量比反应物的总能量高时,则为吸热反应,故B错误;
C. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,浓硫酸稀释放热,所以将含0.5molH2SO4的浓硫酸与含lmolNaOH的溶液混合,放出的热量大于57.3kJ,故C错误;
D. 2gH2的物质的量是1mol,完全燃烧生成液态水,放出285.8kJ热量,表示氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1,故D正确;


科目:高中化学 来源: 题型:
【题目】25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
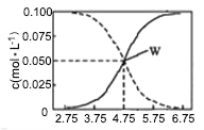
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
B.32.5gFeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.标准状况下,4.48L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.1NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() 3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molBB.3molC+ 1molD+ 1molB
C.6molC + 0.8molDD.1.6molA+0.8molB + 0.6molC+0.3molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
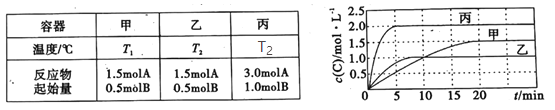
下列说法正确的是( )
A.T1< T2,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }

① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)![]() 的名称是 ______ ;
的名称是 ______ ;
(2)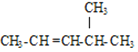 的名称是 ______ ;
的名称是 ______ ;
(3) 的含氧官能团的名称___________________________________
的含氧官能团的名称___________________________________
(4)实验测定某有机物元素质量组成为C:69% H:4.6% N:8.0%,其余是O,该有机物的实验式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com