
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+ | |
| B. | 该电池工作时,盐桥中K+向石墨电极定向移动 | |
| C. | 若用此电池电解饱和食盐水制取Cl2,当铜电极的质量减少6.4g时,产生氯气的体积为2.24 L | |
| D. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
分析 由图可知,左侧Cu失去电子,右侧铁离子得到电子,形成原电池,阳离子向正极移动,电子由负极流向正极,且原电池与电解中电子守恒,以此来解答.
解答 解:A.由图可知,Cu失电子,铁离子得电子,该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+,故A正确;
B.阳离子向正极移动,则该电池工作时,盐桥中K+向石墨电极定向移动,故B正确;
C.由电子守恒可知,当铜电极的质量减少6.4g时,产生氯气为$\frac{6.4g}{64g/mol}$=0.1mol,但Vm未知,不能计算其体积,故C错误;
D.Cu为负极,石墨为正极,电池工作过程中,电子由铜电极经过电流表流向石墨电极,故D正确;
故选C.
点评 本题考查原电池,为高频考点,把握原电池工作原理、物质的量计算等为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
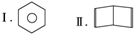
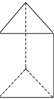 的立体结构,该结构的二氯代物有3种.
的立体结构,该结构的二氯代物有3种.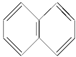 ,该结构简式不能解释萘的下列A事实(填编号).
,该结构简式不能解释萘的下列A事实(填编号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
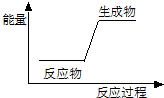
| A. | 生石灰和水的反应 | B. | 木炭在氧气中燃烧 | ||
| C. | 石灰石在高温下的分解反应 | D. | 盐酸与氢氧化钠溶液的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
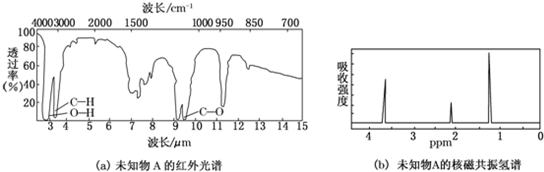
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C15H31COOH和C17H35COOH是同系物 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. | 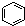 和 和 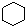 均是芳香烃, 均是芳香烃,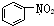 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 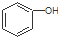 和 和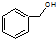 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com