
| A. | 碘和干冰的升华 | |
| B. | 分别将NaHSO4熔化、溶解于水 | |
| C. | HCl和MgCl2的溶解 | |
| D. | 常压下分别将NaHCO3高温加热、溶解于水 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A、碘和干冰均为分子晶体,升华时克服的均为分子间作用力,故A正确;
B、NaHSO4熔化断开的只有离子键,即克服的是离子键;而溶于水后,离子键和H与S原子间的共价键均断裂,故克服的是离子键和共价键,故B错误;
C、HCl分子内是共价键,故溶于水后克服的是共价键;而氯化镁是离子化合物,故溶于水时克服的是离子键,故C错误;
D、将NaHCO3高温加热时会分解为Na2CO3、二氧化碳和水,NaHCO3中的Na+与HCO3-间的离子键、H与C之间的共价键、O与C之间的共价键均断裂;而将NaHCO3溶于水中,断开的是Na+与HCO3-间的离子键和部分H与C之间的共价键,故D错误.
故选A.
点评 本题考查了不同类型晶体中微粒间的作用力,此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.


科目:高中化学 来源: 题型:填空题
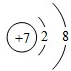 可知,氮原子最外层电子数目为5
可知,氮原子最外层电子数目为5查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  曲线可表示向0.1 mol/L CH3COONa溶液中加水稀释的过程中OH-浓度随溶液体积的变化趋势 | |
| B. | 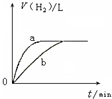 曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)跟同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. |  曲线c、d分别表示等质量的铝分别跟过量烧碱溶液、过量盐酸反应过程中产生H2体积的变化趋势 | |
| D. | 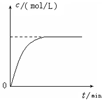 曲线可表示足量锌与一定量稀醋酸反应过程中,Zn2+浓度的变化趋势(假设反应过程中溶液体积保持不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | KHSO4═K++HSO4- | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Cr2O${\;}_{7}^{2-}$、Fe3+、SCN-、Cl- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、K+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012 的溶液中:S2O${\;}_{3}^{2-}$、CrO${\;}_{4}^{2-}$、Cl-、Mg2+ | |
| D. | 水电离的c (H)=10-12mol•L-1 的溶液中:HCO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$、Cu2+、NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸汽和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | HCl与NaOH反应的中和热△=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-2×(-57.3)kJ•mol-1 | |
| D. | 一定条件下,0.2molSO2(g)与0.1molO2(g)混合充分反应时放出的热量为18kJ,则有SO2(g)+O2(g)═2SO3(g)△H=-180kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、SO42- | B. | K+、Mg2+,Cl- | ||
| C. | Ca2+,CO32-,OH- | D. | Ba2+,CO32-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
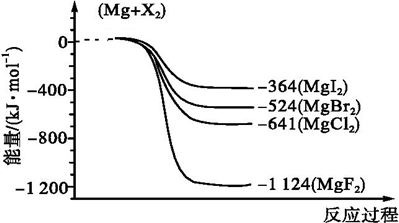
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com