

| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间N2加热 | A中固体变为红棕色,B中有白色沉淀生成,D试管中有无色液体生成 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将重所得溶液滴入D试管中 | 混合溶液变为浅绿色 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
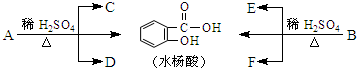
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高分子分离膜可用于海水和苦咸水的淡化方面 |
| B、加热时,用高分子膜可浓缩天然果汁 |
| C、传感膜能够把化学能转化为电能 |
| D、热电膜能够把热能转换为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 中和反应 | 溶 解 | 产生氢气 | |
| B | 有银镜 | 加热后有红色沉淀 | 产生氢气 | |
| C | 水解反应 | 有银镜 | 加热后有红色沉淀 | |
| D | 水解反应 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
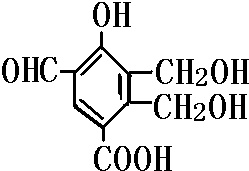 如图为某有机物的结构简式,则等物质的量的该物质分别与Na,NaOH,NaHCO3反应是消耗的物质的量之比是( )
如图为某有机物的结构简式,则等物质的量的该物质分别与Na,NaOH,NaHCO3反应是消耗的物质的量之比是( )| A、4:2:1 |
| B、3:2:1 |
| C、1:1:1 |
| D、1:2:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com