
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

分析 (1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
③合成氨反应中,在500℃左右催化剂活性最高;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
(3)氮气在阴极得电子生成氨气;
(4)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
③合成氨反应中,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适;
故答案为:从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大;
故答案为:A;р2>р1;
(3)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3;
(4)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
点评 本题考查了平衡常数的应用、合成氨反应的条件选择、影响化学平衡的因素、电解原理的应用、盖斯定律的应用等,题目难度中等,侧重于基础知识的综合应用考查,注意把握K与温度的关系以及影响化学平衡的因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

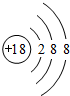 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2 SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| T/℃ | 50 | 60 | 70 | 80 | 90 |
| c/mol.L-1 | 1.0 | 3.0 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 油脂在酸性条件下可水解生成高级脂肪酸和甘油 | |
| C. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,V正、V逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数 | |
| C. | 降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数 | |
| D. | 增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆增大倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2 s 的平均速率v(CO)=0.080mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=“0.11“mol•L-1,则反应的△H<0 | |
| C. | T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正<v逆 | |
| D. | T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com