
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.分析 (1)过氧化钠是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,过氧化钠与水反应生成氢氧化钠与氧气;
(2)能使H2O2产生气体通常用MnO2作催化剂,据此答题;
(3)①KMnO4溶液具有氧化性,盛装在酸式滴定管;
②反应中锰元素化合价+7价变化为+2价,氧元素化合价-1价变化为0价,电子转移总数10e-,标注电子转移的方向和数目;
③根据KMnO4与H2O2反应的物质的量之比求得H2O2的物质的量,进而求得溶液a中c(H2O2);
④一般情况下在开始时反应物浓度较大,反应速率应当较快,但现在是溶液褪色速率开始较慢后变快,则可能是产生新的物质,且此物质对反应有催化作用,从而加快了反应速率,据此分析;
解答 解:(1)过氧化钠是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为: ,过氧化钠与水反应生成氢氧化钠与氧气,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
,过氧化钠与水反应生成氢氧化钠与氧气,离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
故答案为: ;2Na2O2+2H2O=4Na++4OH-+O2↑;
;2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)能使H2O2产生气体通常用MnO2作催化剂,过氧化氢分解生成水和氧气,
故答案为:MnO2;
(3)①KMnO4溶液具有氧化性,能氧化橡胶管,盛装在酸式滴定管,
故答案为:酸;
②离子方程式:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,反应中锰元素化合价+7价变化为+2价,氧元素化合价-1价变化为0价,电子转移总数10e-,
用单线桥标出该反应电子转移的方向和数目: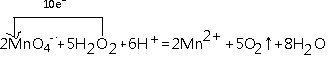
故答案为: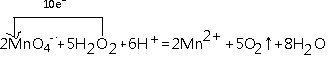 ;
;
③根据KMnO4与H2O2反应的离子方程式可知关系式为:
2MnO4-~~~~~5H2O2
2mol 5mol
0.002mol•L-1×0.01L n(H2O2)
∴n(H2O2)=5×10-5mol
∴c(H2O2)=$\frac{5×1{0}^{-5}mol}{0.02L}$=0.0025 mol/L
故答案为:0.0025 mol/L;
④一般情况下在开始时反应物浓度较大,反应速率应当较快,但现在是溶液褪色速率开始较慢后变快,则可能是产生新的物质,且此物质对反应有催化作用,从而加快了反应速率,根据离子反应2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,可知,起催化作的产物为Mn2+;
故答案为:反应生成的Mn2+作催化剂.
点评 本题以物质的性质为背景,考查了离子方程式书写、化学计算、实验分析,对学生综合运用元素化合物知识的能力要求较高,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| C. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| D. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间小于10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境无污染 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 往新制备的氯水中和SO2的水溶液中分别滴入石蕊试液时的现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com