
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42-
B.使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3-
C.由水电离的c(OH-)=10-13mol·L-1的溶液中:Na+、Cl-、CO32-、NO3-
D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、NO3-
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:填空题
(12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:

(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.工业上电解熔融的Al2O3冶炼铝用铁做阳极
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子 转移,则生成2 molNaOH
转移,则生成2 molNaOH
D.用惰性电极电解CuSO4溶液一段时间后,加入CuO固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
一定条件下进行反应:A(g) B(g)+C (g),向2.0 L恒容密闭容器中充入1.0 mol A(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
B(g)+C (g),向2.0 L恒容密闭容器中充入1.0 mol A(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.反应前2min的平均速率v(B)=0.15 mol/(L·min)
B.保持其他条件不变,升高温度,平衡时c(B)=0.22 mol·L-1,则反应的ΔH < 0
C.保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小
D.保持其他条件不变,起始向容器中充入1.2 mol A、0.60 mol B和0.60 mol C,反应达到平衡前的速率:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
物质 组别 | 甲 | 乙 | 丙 |
A | FeCl2 | Cl2 | NaOH |
B | SiO2 | NaOH | HF |
C | AlCl3 | KOH | H2SO4 |
D | SO2 | NaOH | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:实验题
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
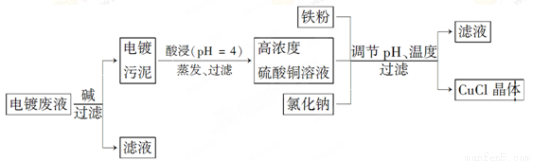
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
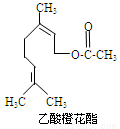
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为 。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为 。

(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。

则这种堆积模型的配位数为 ,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为 g/cm3(不必化简)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列电离或离子方程式正确的是
A.亚硫酸的电离方程为:H2SO3H++HSO3-
B.NaHS水解的离子方程式为:HS-+H2OH3O++S2-
C.氯化铵水解的离子方程式为: NH4+ +H2ONH3·H2O+H+
D.Na2CO3水解的离子方程式为:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com